Болка е много важна функция на човешкото тяло, включително участието на ноцицепторите и централната нервна система, или ЦНС, за предаване на съобщения от вредна стимулация към мозъка. Ноцицепторите са надбъбречни жлези, които са отговорни за откриването на опасни или вредни стимули и предаването на електрически сигнали в нервната система. Рецепторите присъстват в кожата, вътрешностите, мускулите, ставите и менингите, за да открият диапазон от стимулация, която може да бъде механична, термична или химична.
Има два вида ноцицептори:
- С-влакната биха били най-често срещаният тип и са бавни за провеждане и реагиране на стимули. Тъй като протеините в мембраната на рецептора превръщат стимулацията в електрически импулси, които могат да бъдат поети през нервната система.
- Известно е, че A-делта влакната провеждат по-бързо и предават съобщения за остра, моментна болка.
Освен това има тихи ноцицептори, които обикновено са ограничени до стимули, но могат да бъдат „събудени“ с високоинтензивна механична стимулация в отговор на химически медиатори от тялото. Ноцицепторите могат да имат много различни зависими от напрежение станции за трансдукция, които предизвикват набор от потенциали за действие, за да започне електрическата сигнализация към нервната система. Възбудимостта и поведението на клетката се основават на видовете канали в ноцицептора.
Важно е да се прави разлика между ноцицепция и болка, когато се разглежда механизмът на болката. Ноцицепцията е нормалната реакция на тялото към вредни стимули, включително рефлекси под надпрага, които предпазват човешкото тяло от нараняване. Болката се възприема само когато се достигне суперпрагът за тези ноцицептори да достигнат възможно действие и да инициират пътя на болката, който е сравнително висок. Целта на статията по-долу е да демонстрира клетъчните и молекулярните механизми на болката, включително остра болка и хронична болка, или постоянна болка, както е посочено по-долу.
Съдържание
Клетъчни и молекулярни механизми на болката
абстрактен
Нервната система открива и интерпретира широк спектър от термични и механични стимули, както и екологични и ендогенни химически дразнители. Когато са интензивни, тези стимули генерират остра болка и в условията на продължително нараняване, компонентите на периферната и централната нервна система на пътя за предаване на болката проявяват огромна пластичност, засилвайки сигналите за болка и предизвиквайки свръхчувствителност. Когато пластичността улеснява защитните рефлекси, това може да бъде от полза, но когато промените продължават, може да се получи хронична болка. Генетичните, електрофизиологичните и фармакологичните изследвания изясняват молекулярните механизми, които са в основата на откриването, кодирането и модулирането на вредни стимули, които генерират болка.
Въведение: Остра срещу постоянна болка
Способността за откриване на вредни стимули е от съществено значение за оцеляването и благосъстоянието на организма. Това е драматично илюстрирано от изследване на лица, които страдат от вродени аномалии, които ги правят неспособни да откриват болезнени стимули. Тези хора не могат да усетят пронизваща болка от остър предмет, топлина от открит пламък или дори дискомфорт, свързан с вътрешни наранявания, като например счупена кост. В резултат на това те не прилагат подходящо защитно поведение срещу тези състояния, много от които могат да бъдат животозастрашаващи.
По-често промените в пътя на болката водят до свръхчувствителност, така че болката надживява своята полезност като система за остро предупреждение и вместо това става хронична и изтощаваща. Това може да се разглежда на някакво ниво като продължение на нормалния лечебен процес, при което увреждането на тъканите или нервите предизвиква хиперактивност, за да насърчи охраната на увредената област. Например, слънчевото изгаряне води до временна сенсибилизация на засегнатата област. В резултат на това нормално безобидни стимули, като леко докосване или топлина, се възприемат като болезнени (феномен, посочен като алодиния), или нормално болезнените стимули предизвикват болка с по-голяма интензивност (наричана хипералгезия). В крайна степен сенсибилизацията не отшумява. Наистина, хората, които страдат от артрит, пост-херпетична невралгия (след пристъп на херпес зостер) или рак на костите, изпитват интензивна и често непрестанна болка, която е не само физиологично и психологически инвалидизираща, но също така може да попречи на възстановяването. Хроничната болка може дори да продължи дълго след остро нараняване, може би най-често срещана като болка в долната част на гърба или ишиас.
Синдромите на персистираща или хронична болка могат да бъдат инициирани или поддържани в периферните и/или централните локуси. И в двата случая, изясняването на молекулите и клетъчните типове, които са в основата на нормалното (остро) усещане за болка, е ключово за разбирането на механизмите, лежащи в основата на свръхчувствителността към болка. В настоящия преглед ние подчертаваме молекулярната сложност на първичните аферентни нервни влакна, които откриват вредни стимули. Ние не само обобщаваме обработката на острата болка, но също така описваме как настъпват промени в обработката на болката при нараняване на тъкани или нерви.
Дълбоките разлики между острата и хроничната болка подчертават факта, че болката не се генерира от неизменна, твърдо свързана система, а по-скоро е резултат от ангажирането на силно пластични молекули и вериги, чиято молекулярна биохимична и невроанатомична основа са в центъра на вниманието на текущи проучвания. Важно е, че тази нова информация идентифицира множество потенциални терапевтични цели за лечение на болка. Тук се фокусираме върху периферните неврони и невроните от втори ред в гръбначния мозък; читателят се препраща към някои отлични прегледи на механизмите за обработка на супраспиналната болка, които включват забележителни прозрения, които изследванията с изображения донесоха в тази област (Apkarian et al., 2005).
Анатомичен преглед
Ноцицепцията е процесът, чрез който интензивни термични, механични или химични стимули се откриват от субпопулация от периферни нервни влакна, наречени ноцицептори (Basbaum and Jessell, 2000). Клетъчните тела на ноцицепторите са разположени в ганглиите на гръбначния корен (DRG) за тялото и тригеминалния ганглий за лицето и имат както периферен, така и централен аксонен клон, който инервира съответно техния целеви орган и гръбначния мозък. Ноцицепторите се възбуждат само когато интензитетите на стимула достигнат вредния диапазон, което предполага, че притежават биофизични и молекулярни свойства, които им позволяват селективно да откриват и да реагират на потенциално вредни стимули. Има два основни класа ноцицептори. Първият включва миелинизирани (A?) аференти със среден диаметър, които медиират остра, добре локализирана „първа“ или бърза болка. Тези миелинизирани аференти се различават значително от по-големия диаметър и бързо провеждащи A? влакна, които реагират на безобидна механична стимулация (т.е. леко докосване). Вторият клас ноцицептори включва немиелинизирани "С" влакна с малък диаметър, които предават лошо локализирана, "втора" или бавна болка.
Електрофизиологичните изследвания допълнително подразделиха A? ноцицептори в два основни класа. Тип I (HTM: механични ноцицептори с висок праг) реагират както на механични, така и на химични стимули, но имат относително високи топлинни прагове (>50C). Ако обаче топлинният стимул се запази, тези аференти ще реагират при по-ниски температури. И най-важното е, че те ще се сенсибилизират (т.е. топлинният или механичният праг ще спадне) при нараняване на тъканите. Тип II A? ноцицепторите имат много по-нисък топлинен праг, но много висок механичен праг. Активността на този аферент почти със сигурност медиира „първата“ реакция на остра болка към вредната топлина. Действително, компресионният блок на миелинизирани периферни нервни влакна елиминира първата, но не и втората болка. Обратно, влакното тип I вероятно медиира първата болка, провокирана от убождане с игла и други интензивни механични стимули.
Немиелинизираните C влакна също са хетерогенни. Подобно на миелинизираните аференти, повечето C влакна са полимодални, тоест включват популация, която е едновременно топлинно и механично чувствителна (CMHs) (Perl, 2007). От особен интерес са чувствителните към топлина, но механично нечувствителни немиелинизирани аференти (така наречените тихи ноцицептори), които развиват механична чувствителност само в условията на нараняване (Schmidt et al., 1995). Тези аференти са по-отзивчиви към химични стимули (капсаицин или хистамин) в сравнение с CMHs и вероятно влизат в игра, когато химическата среда на възпаление променя свойствата им. Подгрупи от тези аференти също реагират на различни сърбежи, предизвикващи сърбеж. Струва си да се отбележи, че не всички C влакна са ноцицептори. Някои реагират на охлаждане, а особено интересна популация от немиелинизирани аференти реагира на безобидно поглаждане на окосмената кожа, но не и на топлинна или химическа стимулация. Тези последни влакна изглежда посредничат за приятно докосване (Olausson et al., 2008).
Невроанатомичната и молекулярна характеристика на ноцицепторите допълнително демонстрира тяхната хетерогенност, особено за C влакната (Snider and McMahon, 1998). Например, така наречената "пептидергична" популация от C ноцицептори освобождава невропептидите, субстанцията P и пептида, свързан с калцитонин-гена (CGRP); те също така експресират TrkA невротрофиновия рецептор, който реагира на нервния растежен фактор (NGF). Непептидергичната популация на C ноцицептори експресира c-Ret невротрофиновия рецептор, който е насочен към невротрофичен фактор, получен от глиал (GDNF), както и невртурин и артемин. Голям процент от c-Ret-положителната популация също свързва IB4 изолектина и експресира G протеин-свързани рецептори от семейството Mrg (Dong et al., 2001), както и специфични пуринергични рецепторни подтипове, по-специално P2X3. Ноцицепторите могат да бъдат разграничени и според тяхната диференциална експресия на канали, които придават чувствителност към топлина (TRPV1), студ (TRPM8), киселинна среда (ASICs) и множество химически дразнители (TRPA1) (Julius and Basbaum, 2001). Както е отбелязано по-долу, тези функционално и молекулярно хетерогенни класове ноцицептори се свързват със специфична функция при откриването на различни модалности на болка.
Ноцицепторът: двупосочна сигнална машина
Обикновено се смята, че ноцицепторът носи информация в една посока, предавайки вредни стимули от периферията към гръбначния мозък. Въпреки това, първичните аферентни влакна имат уникална морфология, наречена псевдо-униполярна, при която както централните, така и периферните терминали произлизат от обща аксонална дръжка. По-голямата част от протеините, синтезирани от DRG или тригеминалната ганглиозна клетка, се разпределят както в централните, така и в периферните терминали. Това отличава първичния аферентен неврон от прототипния неврон, където реципиентният клон на неврона (дендритът) е биохимично различен от предавателния клон (аксона). Биохимичната еквивалентност на централните и периферните терминали означава, че ноцицепторът може да изпраща и получава съобщения от двата края. Например, както централният терминал е мястото на освобождаване на Са2+-зависим невротрансмитер, така и периферният терминал освобождава различни молекули, които влияят на локалната тъканна среда. Неврогенното възпаление всъщност се отнася до процеса, при който периферното освобождаване на невропептидите, CGRP и субстанция P, предизвиква вазодилатация и екстравазация на плазмените протеини, съответно (Basbaum and Jessell, 2000). Освен това, докато само периферният терминал на ноцицептора ще реагира на стимули от околната среда (болезнена топлина, студ и механична стимулация), както периферните, така и централните терминали могат да бъдат насочени от множество ендогенни молекули (като рН, липиди и невротрансмитери) които регулират неговата чувствителност. От това следва, че терапевтичните средства, насочени към двата терминала, могат да бъдат разработени, за да повлияят на предаването на съобщения за болка. Например, спиналната (интратекална) доставка на морфин е насочена към опиоидните рецептори, експресирани от централния терминал на ноцицепторите, докато локално прилаганите лекарства (като локални анестетици или капсаицин) регулират болката чрез действие в периферния терминал.
Централни проекции на ноцицептора
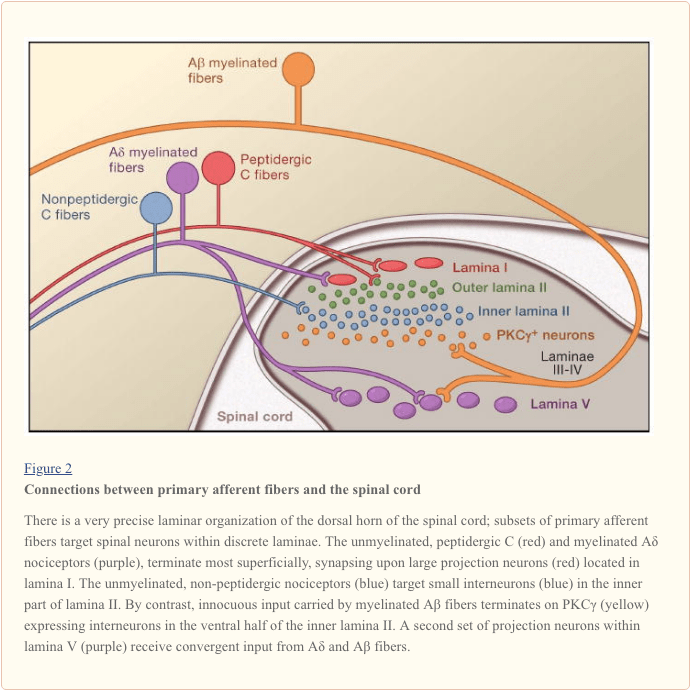
Първичните аферентни нервни влакна се проектират към дорзалния рог на гръбначния мозък, който е организиран в анатомично и електрофизиологично различни ламини (Basbaum and Jessell, 2000) (Фигура 1). Например, А? ноцицепторите се проектират към ламина I, както и към по-дълбокия гръбен рог (ламина V). Ниският праг, бързо провеждащ A? аферентите, които реагират на леко докосване, проектират към дълбоки ламини (III, IV и V). За разлика от тях, C-ноцицепторите се проектират по-повърхностно към ламини I и II.
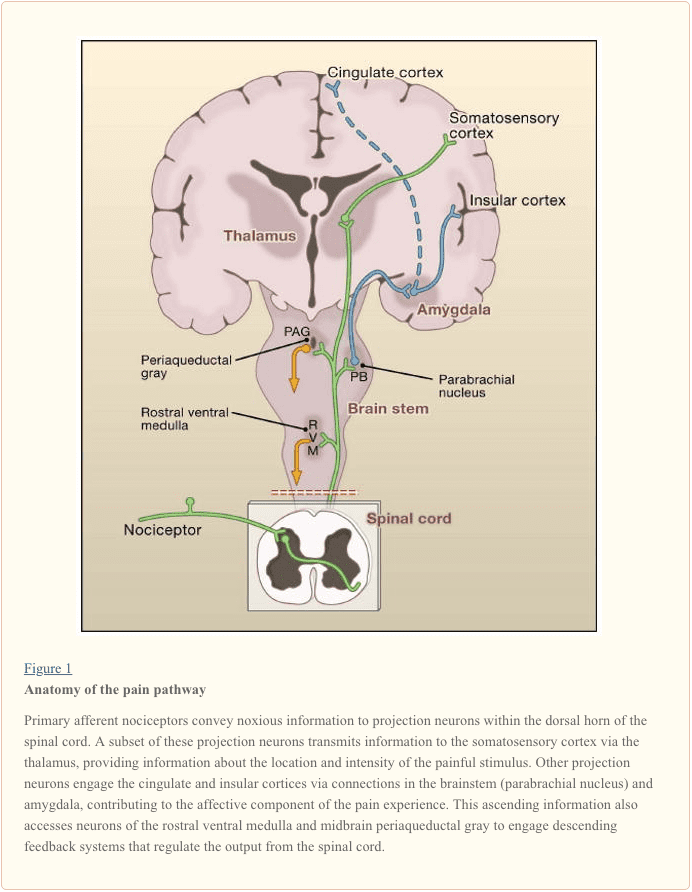
Тази забележителна стратификация на аферентни подтипове в повърхностния гръбен рог е допълнително подчертана от отделните проекционни модели на C ноцицепторите (Snider and McMahon, 1998). Например, повечето пептидергични С влакна завършват в ламина I и най-дорзалната част на ламина II. Обратно, непептидергичните аференти, включително подгрупата, експресираща Mrg, завършват в средната област на ламина II. Най-вентралната част на ламина II се характеризира с наличието на възбуждащи интерневрони, които експресират гама изоформата на протеин киназа С (PKC), която е замесена в индуцирана от нараняване персистираща болка (Malmberg et al., 1997). Последните проучвания показват, че този PKC? слой е насочен предимно от миелинизирани неноцицептивни аференти (Neumann et al., 2008). В съответствие с тези анатомични изследвания, електрофизиологичните анализи показват, че невроните на гръбначния мозък в рамките на ламина I обикновено реагират на вредна стимулация (чрез A? и C влакна), невроните в ламина III и IV реагират предимно на безвредна стимулация (чрез A?) и невроните в ламина V получават конвергентен не-вреден и вреден вход чрез директен (моносинаптичен) A? и А? входове и индиректни (полисинаптични) входове на C влакна. Последните се наричат неврони с широк динамичен диапазон (WDR), тъй като те реагират на широк спектър от интензитети на стимула. Обикновено има и висцерален вход към тези WDR неврони, така че получената конвергенция на соматични и висцерални вероятно допринася за феномена на препоръчана болка, при което болката, вторична след нараняване, засягащо висцералната тъкан (например сърцето при ангина) е се отнася до соматична структура (например рамото).
Възходящи пътища и супраспинална обработка на болката
Проекционните неврони в ламината I и V представляват основния изход от дорзалния рог към мозъка (Basbaum and Jessell, 2000). Тези неврони са в основата на множество възходящи пътища, включително спиноталамичния и спиноретикулоталамичния тракт, които носят съобщения за болка съответно до таламуса и мозъчния ствол (Фигура 2). Първият е особено релевантен за сензорно-дискриминативните аспекти на болката (т.е. къде е стимулът и колко е интензивен?), докато вторият може да е по-подходящ за лошо локализирани болки. Съвсем наскоро вниманието се съсредоточи върху проекциите на гръбначния мозък към парабрахиалната област на дорзолатералния мост, тъй като изходът на този регион осигурява много бърза връзка с амигдалата, област, която обикновено се смята за обработваща информация, свързана с аверсивните свойства на болката. опит.
От тези мозъчни стволови и таламични локуси информацията достига до кортикалните структури. Няма отделна мозъчна област от съществено значение за болката (Apkarian et al., 2005). По-скоро болката е резултат от активиране на разпределена група от структури, някои от които са по-свързани със сензорно-дискриминативните свойства (като соматосензорната кора), а други с емоционалните аспекти (като предния цингулатен gyrus и островната кора). Съвсем наскоро изследванията с изображения показват активиране на префронталните кортикални зони, както и региони, които обикновено не са свързани с обработката на болката (като базалните ганглии и малкия мозък). Дали и до каква степен активирането на тези региони е по-свързано с реакцията на индивида към стимула, или с възприемането на болката, не е ясно. И накрая, Фигура 2 илюстрира мощните низходящи контроли, които влияят (както положително, така и отрицателно) на предаването на съобщения за болка на нивото на гръбначния мозък.
Остра болка
Първичното аферентно нервно влакно открива стимули от околната среда (от топлинно, механично или химично естество) и предава тази информация на езика на нервната система, а именно електрически ток. Първо, ние правим преглед на напредъка в разбирането на молекулярната основа на откриването на сигнала и следваме това с кратък преглед на последните генетични изследвания, които подчертават приноса на волтаж-зависимите канали към предаването на болка (Фигура 3).
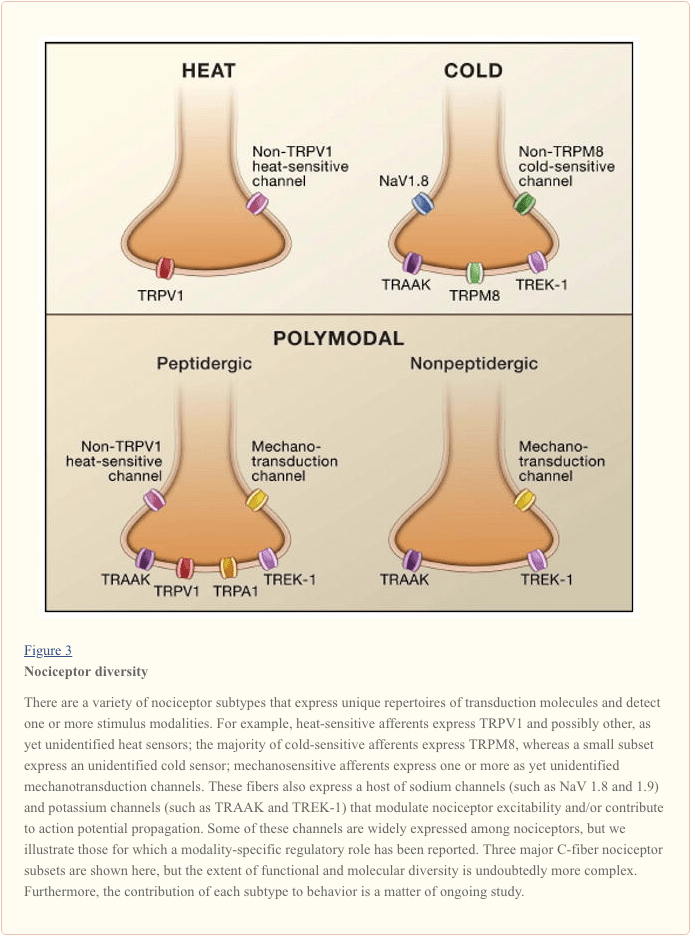
Активиране на ноцицептора: Топлина
Човешките психофизични изследвания показват, че има ясно и възпроизводимо разграничение между възприемането на безобидна топлина и вредна топлина, което ни позволява да разпознаваме и избягваме температури, способни да причинят увреждане на тъканите. Този праг на болка, който обикновено е около 43°C, е паралел на топлинната чувствителност на C и Тип II A? ноцицептори, описани по-рано. Всъщност култивираните неврони от дисоциирани ганглии на гръбначния корен показват подобна топлинна чувствителност. Повечето показват праг от 43°C, с по-малка кохорта, активирана от по-интензивна топлина (праг >50°C) (Cesare and McNaughton, 1996; Kirschstein et al., 1997; Leffler et al., 2007; Nagy and Rang , 1999). Молекулярните прозрения за процеса на усещане за топлина идват от клонирането и функционалната характеристика на рецептора за капсаицин, основната остра съставка в „лютите“ люти чушки. Капсаицинът и свързаните с него ванилоидни съединения предизвикват пареща болка чрез деполяризиране на специфични подгрупи на C и A? ноцицептори чрез активиране на капсаицин (или ванилоиден) рецептор, TRPV1, един от приблизително 30 члена на семейството на йонните канали с по-голям преходен рецепторен потенциал (TRP) (Caterina et al., 1997). Клонираният канал TRPV1 също се затваря от повишаване на температурата на околната среда, с праг на термично активиране (-43°C).
Няколко линии от доказателства подкрепят хипотезата, че TRPV1 е ендогенен преобразувател на вредна топлина. Първо, TRPV1 се експресира в повечето топлочувствителни ноцицептори (Caterina et al., 1997). Второ, токове, предизвикани от капсаицин и топлина, са сходни, ако не и идентични, по отношение на техните фармакологични и биофизични свойства, както и тези на хетероложно експресираните TRPV1 канали. Трето, както е описано по-подробно по-долу, TRPV1-предизвиканите отговори са значително засилени от про-алгетични или про-възпалителни агенти (като извънклетъчни протони, невротрофини или брадикинин), всички от които предизвикват свръхчувствителност към топлина in vivo (Tominaga et. др., 1998)). Четвърто, анализът на мишки без този йонен канал не само разкрива пълна загуба на чувствителност към капсаицин, но тези животни също показват значително увреждане в способността си да откриват и реагират на вредна топлина (Caterina et al., 2000; Davis et al., 2000). ). Тези проучвания също така демонстрират съществена роля на този канал в процеса, при който увреждането и възпалението на тъканите водят до свръхчувствителност към топлина, отразявайки способността на TRPV1 да служи като молекулен интегратор на термични и химични стимули (Caterina et al., 2000; Davis et al. ., 2000).
Приносът на TRPV1 към острото усещане за топлина обаче е оспорен от данни, събрани от препарат ex vivo, в който записи се получават от сома на DRG неврони с непокътнати централни и периферни влакна. В едно проучване не са наблюдавани разлики в реакциите, предизвикани от топлина от див тип и животни с дефицит на TRPV1 (Woodbury et al., 2004), но по-скорошен анализ от тази група установи, че мишките с дефицит на TRPV1 наистина нямат кохорта от неврони, силно активирани от вредна топлина (Lawson et al., 2008). Взети заедно с описаните по-горе резултати, ние заключаваме, че TRPV1 несъмнено допринася за острото усещане за топлина, но сме съгласни, че TRPV1 не е единствено отговорен за топлинната трансдукция.
В тази връзка, докато при мишките с дефицит на TRPV1 липсва компонент на поведенческа топлинна чувствителност, използването на висока доза капсаицин за аблация на централните терминали на TRPV1-експресиращи първични аферентни влакна води до по-дълбока, ако не и пълна загуба на чувствителност към остра топлинна болка (Кавано и др., 2009). Що се отнася до мутанта TRPV1, има и загуба на топлинна хипералгезия, предизвикана от увреждане на тъканите. Взети заедно, тези резултати показват, че както TRPV1-зависимият, така и TRPV1-независимият компонент на чувствителността към вредна топлина се медиира чрез TRPV1-експресиращи ноцицептори.
Какво обяснява TRPV1-независимия компонент на усещането за топлина? Редица други подтипове канали на TRPV, включително TRPV2, 3 и 4, се появиха като кандидат топлинни преобразуватели, които потенциално биха могли да покрият откриването на интензитети на стимула, заобикалящи този на TRPV1, включително както много горещи (>50°C), така и топли (среда 30). °Cs) температури (Lumpkin and Caterina, 2007). Хетероложно експресираните TRPV2 канали показват температурен праг на активиране от ?52°C, докато TRPV3 и TRPV4 се активират между 25 – 35°C. TRPV2 се изразява в субпопулация от A? неврони, които реагират на високопрагова вредна топлина и неговите биофизични свойства наподобяват тези на естествените високопрагови топлинно предизвикани токове (Leffler et al., 2007; Rau et al., 2007). Все още няма публикувани доклади, описващи физиологични или поведенчески тестове на мишки с нокаут TRPV2. От друга страна, мишките с дефицит на TRPV3 и TRPV4 показват променени термични предпочитания, когато са поставени върху повърхност с градуирани температури, което предполага, че тези канали допринасят по някакъв начин за откриване на температура in vivo (Guler et al., 2002). Интересно е, че както TRPV3, така и TRPV4 показват значително по-голяма експресия в кератиноцитите и епителните клетки в сравнение със сензорните неврони, повишавайки възможността откриването на безвредни топлинни стимули да включва функционално взаимодействие между кожата и основните първични аферентни влакна (Chung et al., 2003; Peier et al., 2002b).
Активиране на ноцицептора: Студ
Що се отнася до капсаицина и TRPV1, естествените охлаждащи агенти, като ментол и евкалиптол, са били използвани като фармакологични сонди за идентифициране и характеризиране на чувствителни към студ влакна и клетки (Hensel и Zotterman, 1951; Reid and Flonta, 2001) и молекулите, които под тяхното поведение. Всъщност повечето чувствителни към студ неврони реагират на ментол и показват праг на термично активиране от ?25°C. TRPM8 е студен и ментол-чувствителен канал, чиито физиологични характеристики съвпадат с тези на естествените студови течения и мишките с дефицит на TRPM8 показват много значителна загуба на ментол и предизвикани от студ отговори на ниво клетъчно или нервно влакно. По същия начин тези животни показват тежки дефицити в предизвиканите от студа поведенчески реакции (Bautista et al., 2007; Colburn et al., 2007; Dhaka et al., 2007) в широк диапазон от температури, обхващащи 30 до 10°C. Както в случая с TRPV1 и he at, мишките с дефицит на TRPM8 не са напълно нечувствителни към студ. Например, остава малка (-4%) кохорта от чувствителни към студ, нечувствителни към ментол неврони, които имат нисък праг на активиране, приблизително 12°C. Това може да обясни остатъчната чувствителност към студ, наблюдавана при поведенчески тестове, при които животните с дефицит на TRPM8 все още могат да избягват изключително студени повърхности под 10°C. Важно е, че мишките с дефицит на TRPM8 показват нормална чувствителност към вредна топлина. Всъщност TRPV1 и TRPM8 се експресират в до голяма степен неприпокриващи се невронни популации, в съответствие с идеята, че механизмите за откриване на горещо и студено са организирани в анатомично и функционално различни „маркирани линии“.
Въз основа на хетероложни експресионни системи, TRPA1 също е предложено да открива студ, по-специално в рамките на вредния (<15°C) диапазон. Освен това TRPA1 се активира от охлаждащите съединения ицилин и ментол (Bandell et al., 2004; Karashima et al., 2007; Story et al., 2003), макар и в относително високи концентрации в сравнение с техните действия при TRPM8. Въпреки това, продължава да има разногласия относно това дали естественият или рекомбинантният TRPA1 са вътрешно чувствителни към студ (Bandell et al., 2004; Jordt et al., 2004; Karashima et al., 2009; Nagata et al., 2005; Zurborg et al. ., 2007). Това противоречие не е разрешено чрез анализа на две независими миши линии с дефицит на TRPA1. На клетъчно ниво едно проучване показва нормални предизвикани от студ отговори в неврони с дефицит на TRPA1 след 30 секундно спадане на температурата от 22°C до 4°C (Bautista et al., 2006); по-скорошно проучване показва намаляване на чувствителните към студ неврони от 26% (WT) на 10% (TRPA1-/-), когато се тества след 200 секунден спад на температурата, от 30°C до 10°C (Karashima et al. ., 2009). В поведенчески проучвания мишките с дефицит на TRPA1 показват реакции, подобни на тези от дивия тип котила в анализите на студена плоча и предизвикано от ацетон изпарително охлаждане (Bautista et al., 2006). Второ проучване, използващо същите анализи, показа, че женските, но не и мъжките животни с нокаут на TRPA1 показват отслабена студена чувствителност в сравнение с дивия тип котила (Kwan et al., 2006). Karashima et al не откриват разлика в треперенето или латентността на изтегляне на лапа при мъжки или женски мишки с дефицит на TRPA1 при теста за студена плоча, но наблюдават, че продължителното излагане на студената повърхност предизвиква скачане при див тип, но не и животни с дефицит на TRPA1 (Karashima et al. др., 2009). Вероятно, последният фенотип отразява приноса на TRPA1 към студовата чувствителност при нараняване на тъканите, но не и към острата студена болка. В съответствие с последната хипотеза, записите на единични нервни влакна не показват намаляване на чувствителността към остра студ при мишки с дефицит на TRPA1 (Cavanaugh et al., 2009; Kwan et al., 2009). И накрая, заслужава да се отбележи, че третираните с капсаицин мишки, които нямат централни терминали на TRPV1-експресиращи влакна, показват непокътнати поведенчески отговори на студени и вредни студени стимули (Cavanaugh et al., 2009). Тъй като TRPA1 се експресира в подгрупа от TRPV1-позитивни неврони, от това следва, че TRPA1 не е необходим за нормална остра студена чувствителност. Бъдещите проучвания, използващи мишки с дефицит както на TRPM8, така и на TRPA1, ще помогнат за разрешаването на тези проблеми и за идентифициране на молекулите и клетъчните типове, които са в основата на остатъчния TRPM8-независим компонент на студовата чувствителност.
Допълнителни молекули, включително волтаж-зависими натриеви канали (обсъдени по-долу), волтаж-зависими калиеви канали и двупорови фонови KCNK калиеви канали, се координират с TRPM8 за фина настройка на прагове на студа или за разпространение на потенциали на действие, предизвикани от студ (Viana et al. , 2002; Zimmermann et al., 2007; Noel et al., 2009). Например, специфични инхибитори на Kv1 повишават температурния праг на чувствителните към студ неврони и инжектирането на тези инхибитори в задната лапа на гризача намалява поведенческите реакции към студ, но не и към топлина или механични стимули (Madrid et al., 2009). Два члена на семейството KCNK канали, KCNK2 (TREK-1) и KCNK4 (TRAAK) се експресират в подгрупа от ноцицептори на C-фибри (Noel et al., 2009) и могат да бъдат модулирани от множество физиологични и фармакологични стимули, включително налягане и температура. Освен това, мишки без тези канали показват аномалии в чувствителността към налягане, топлина и студ (Noel et al., 2009). Въпреки че тези открития предполагат, че TREK-1 и TRAAK каналите модулират възбудимостта на ноцицепторите, остава неясно как тяхната присъща чувствителност към физически стимули е свързана с техния in vivo принос към термичната или механична трансдукция.
Активиране на ноцицептора: механично
Соматосензорната система открива количествено и качествено разнообразни механични стимули, вариращи от лека четка на кожата до разтягане на стената на пикочния мехур. Разнообразие от механочувствителни невронални подтипове са специализирани за откриване на този разнообразен набор от механични стимули и могат да бъдат категоризирани според праговата чувствителност. Механорецепторите с висок праг включват C влакна и бавно адаптиращи се A? механорецепторни (AM) влакна, като и двете завършват като свободни нервни окончания в кожата. Механорецепторите с нисък праг включват A? D-влакна за коса, които завършват на пухени косми в кожата и откриват леко докосване. И накрая, А? влакна, които инервират клетките на Меркел, телцата на Пачин и космените фоликули, откриват текстура, вибрации и лек натиск.
Както и в случая с термични стимули, механичната чувствителност е изследвана на редица нива, включително дисоциирани сензорни неврони в културата, ex-vivo записи на влакна, както и записи от централни (т.е. неврони на дорзалния рог) и измервания на поведенческия резултат. Ex-vivo записите на кожните нерви са най-информативни при съпоставянето на свойствата на стимула (като интензивност, честота, скорост и адаптация) към специфични подтипове влакна. Например, А? влакната се свързват предимно с чувствителността към лек допир, докато C и A? влакната са предимно реагиращи на вредни механични удари. На поведенческо ниво механичната чувствителност обикновено се оценява с помощта на две техники. Най-често срещаният включва измерване на рефлексни реакции на постоянна сила, приложена към задната лапа на гризача от калибрирани нишки (влакна на фон Фрей). Вторият прилага нарастващ натиск върху лапата или опашката чрез скоба. И в двата случая информацията за механичните прагове се получава при нормални (остри) или наранявания (свръхчувствителност) ситуации. Едно от предизвикателствата в тази област е да се разработят допълнителни поведенчески анализи, които измерват различни аспекти на механосензацията, като текстурна дискриминация и вибрации, което ще улесни изследването както на вредното, така и на невредно докосване (Wetzel et al., 2007).
На клетъчно ниво може да се приложи натиск върху клетъчните тела на култивирани соматосензорни неврони (или върху техните неврити) с помощта на стъклена сонда, промени в осмотичната сила или разтягане чрез разтягане на еластична културална повърхност, въпреки че не е ясно кой стимул е най-добър имитира физиологичното налягане (Bhattacharya et al., 2008; Cho et al., 2006; Cho et al., 2002; Drew et al., 2002; Hu and Lewin, 2006; Lin et al., 2009; Takahashi and Gotoh, 2000 ). Отговорите могат да бъдат оценени с помощта на електрофизиологични методи или методи за изобразяване на живи клетки. Консенсусът от такива проучвания е, че това налягане отваря механочувствителен катионен канал, за да предизвика бърза деполяризация. Въпреки това, недостигът на специфични фармакологични сонди и молекулярни маркери, с които да се характеризират тези отговори или да се маркират съответните невронни подтипове, възпрепятства опитите за съпоставяне на клетъчните дейности с анатомично или функционално дефинирани подкласове на нервни влакна. Тези ограничения също възпрепятстват молекулярния анализ на механосензацията и идентифицирането на молекули, които съставляват машината за механотрансдукция. Въпреки това се появиха редица кандидати, базирани до голяма степен на проучвания на механосензитивността в моделни генетични организми. Ортолозите при бозайници на тези протеини са изследвани с помощта на подходи за насочване на гени при мишки, при които техниките, споменати по-горе, могат да се използват за оценка на дефицити в механочувствителност на всички нива. По-долу накратко обобщаваме някои от кандидатите, разкрити в тези проучвания.
Кандидат за механотрансдюсери: DEG/ENaC канали
Изследвания на нематод Caenorhabditis elegans (C. elegans) идентифицират mec-4 и mec-10, членове на семействата на дегенеринови/епителни Na+ канали (DEG/ENaC), като механотрансдюсери в невроните на докосването на тялото (Chalfie, 2009). Въз основа на тези проучвания, ортолозите на бозайниците ASIC 1, 2 и 3 са предложени като канали за механотрансдукция. ASIC са киселинно-чувствителни йонни канали, които служат като рецептори за извънклетъчни протони (тъканна ацидоза), произведени по време на исхемия (виж по-долу). Въпреки че тези канали се експресират както от механочувствителни неврони с нисък и висок праг, генетичните изследвания не подкрепят еднакво съществена роля в механотрансдукцията. Мишките без функционални ASIC1 канали показват нормални поведенчески реакции към кожно докосване и малка или никаква промяна в механичната чувствителност, когато се оценяват чрез запис на единично влакно (Page et al., 2004; Price et al., 2000). По същия начин периферните нервни влакна от мишки с дефицит на ASIC2 показват само леко намаляване на изстрелването на потенциала на действие към механични стимули, докато ASIC3-дефицитните влакна показват леко увеличение (не се наблюдава промяна в механичните прагове или изходната поведенческа механична чувствителност при тези животни) ( Price et al., 2001; Roza et al., 2004). Анализът на мишки с дефицит както за ASIC2, така и за ASIC3 също не успява да подкрепи ролята на тези канали в кожната механотрансдукция (Drew et al., 2004). По този начин, въпреки че изглежда, че тези канали играят роля в мускулно-скелетната и исхемичната болка (вижте по-долу), техният принос към механочувствителността остава неразрешен.
Генетичните изследвания показват, че каналите на C. elegans mec-4/mec-10 съществуват в комплекс с стоматин-подобния протеин MEC-2 (Chalfie, 2009). Мишки без MEC-2 ортолог, SLP3, показват загуба на механочувствителност при нисък праг A? и А? влакна, но не и в C влакна (Wetzel et al., 2007). Тези мишки показват променена тактилна острота, но показват нормални реакции на вредно налягане, което предполага, че SLP3 допринася за откриването на безобидни, но не и вредни механични стимули. Не е известно дали SLP3 функционира в комплекс за механотрансдукция или взаимодейства с ASICs в сензорните неврони на бозайници.
Кандидат механотрансдюсери: TRP канали
Както бе отбелязано по-горе, когато се експресира хетероложно, TRPV2 не само реагира на вредна топлина, но и на осмотично разтягане. Освен това, нативните TRPV2 канали в съдовите гладкомускулни клетки се активират чрез директно засмукване и осмотични стимули (Muraki et al., 2003). Ролята на TRPV2 за соматосензорна механотрансдукция in vivo все още не е тествана.
TRPV2 е силно изразен в среден и голям диаметър, A? влакна, които реагират както на механични, така и на термични стимули (Caterina et al., 1999; Muraki et al., 2003). TRPV4 показва умерена експресия в сензорните ганглии, но е по-обилно експресиран в бъбреците и чувствителните към разтягане уротелиални клетки на пикочния мехур (Gevaert et al., 2007; Mochizuki et al., 2009). Когато са хетероложно експресирани, както TRPV2, така и TRPV4 са показали, че реагират на промени в осмотичното налягане (Guler et al., 2002; Liedtke et al., 2000; Mochizuki et al., 2009; Strotmann et al., 2000). Анализът на животни с дефицит на TRPV4 предполага роля в осмосензацията, тъй като нокаутните животни показват дефекти в кръвното налягане, водния баланс и изпразването на пикочния мехур (Gevaert et al., 2007; Liedtke и Friedman, 2003). Тези животни показват нормална остра кожна механосензация, но показват дефицити в модели на механична и термична хипералгезия (Alessandri-Haber et al., 2006; Chen et al., 2007; Grant et al., 2007; Suzuki et al., 2003). По този начин е малко вероятно TRPV4 да служи като първичен механотрансдюсер в сензорните неврони, но може да допринесе за повишена чувствителност към болка, предизвикана от нараняване.
TRPA1 също е предложено да служи като детектор на механични стимули. Хетероложно експресираният TRPA1 при бозайници се активира от мембранни кренатори (Hill and Schaefer, 2007) и ортологът на червея е чувствителен към механично налягане, приложено чрез смукателна пипета (Kindt et al., 2007). Въпреки това, мишките с дефицит на TRPA1 показват само слаби дефекти в механосензорното поведение и резултатите са непоследователни. Две проучвания не съобщават за промяна в механичните прагове при животни с дефицит на TRPA1 (Bautista et al., 2006; Petrus et al., 2007), докато трето проучване съобщава за дефицити (Kwan et al., 2006). По-скорошно проучване показва, че C и A? механочувствителните влакна в TRPA1 нокаутирани животни имат променени отговори на механична стимулация (някои се увеличават, а други намаляват) (Kwan et al., 2009). Не е ясно дали и как тези диференцирани физиологични ефекти се проявяват на ниво поведение. Взети заедно, TRPA1 изглежда не функционира като основен детектор на остри механични стимули, но може би модулира възбудимостта на механочувствителните аференти.
Кандидат механопреобразуватели: KCNK канали
В допълнение към потенциалната роля на механотрансдюсер на KCNK2 и 4 (виж по-горе), KCNK18 е обсъждан за възможния му принос към механосензацията. По този начин KCNK18 е насочен към хидрокси-а-sanshool, острата съставка в зърната от пипер от Сечуан, която предизвиква усещане за изтръпване и вцепеняване, което предполага взаимодействие с чувствителни на допир неврони (Bautista et al., 2008; Bryant and Mezine, 1999; Sugai et al. др., 2005). KCNK18 се експресира в подгрупа от предполагаеми пептидергични C влакна и нископрагови (A?) механорецептори, където служи като основен регулатор на продължителността и възбудимостта на потенциала на действие (Bautista et al., 2008; Dobler et al., 2007). Освен това, sanshool деполяризира осмо- и механочувствителните сензорни неврони с голям диаметър, както и подгрупа от ноцицептори (Bautista et al., 2008; Bhattacharya et al., 2008). Въпреки че не е известно дали KCNK18 е пряко чувствителен към механична стимулация, той може да бъде критичен регулатор на възбудимостта на невроните, участващи в безобидно или вредно усещане за докосване.
В обобщение, молекулярната основа на механотрансдукцията при бозайници далеч не е изяснена. Механичната свръхчувствителност в отговор на увреждане на тъканите или нервите представлява основен клиничен проблем и по този начин изясняването на биологичната основа на докосването при нормални и патофизиологични условия остава едно от основните предизвикателства в соматосензорните изследвания и изследванията на болката.
Активиране на ноцицептора: химически
Химионоцицепцията е процесът, чрез който първичните аферентни неврони откриват дразнители на околната среда и ендогенни фактори, предизвикани от физиологичен стрес. В контекста на острата болка, химионоцицептивните механизми предизвикват нежелателни реакции към различни дразнители от околната среда. Тук отново TRP каналите имат важна роля, което може би не е изненадващо, като се има предвид, че те функционират като рецептори за растителни дразнители, включително капсаицин (TRPV1), ментол (TRPM8), както и острите съставки в растенията от горчица и чесън, изотиоцианати и тиосулфинати (TRPA1) (Bandell et al., 2004; Caterina et al., 1997; Jordt et al., 2004; McKemy et al., 2002; Peier et al., 2002a).
По отношение на дразнителите на околната среда, TRPA1 се очертава като особено интересен член на тази група. Това е така, защото TRPA1 реагира на съединения, които са структурно разнообразни, но обединени в способността си да образуват ковалентни адукти с тиолови групи. Например, алил изотиоцианат (от уасаби) или алицин (от чесън) са пропускливи за мембрана електрофили, които активират TRPA1 чрез ковалентно модифициране на цистеинови остатъци в амино-терминалния цитоплазмен домен на канала (Hinman et al., 2006, Macpherson et al., 2007; 1 г.). Понастоящем не е известно как това насърчава гейтирането на канали. Независимо от това, простото установяване на важността на тиоловата реактивност в този процес включва TRPA2 като ключова физиологична цел за широка и химически разнообразна група от токсични вещества в околната среда. Един забележителен пример е акролеинът (2006-пропенал), силно реактивен ?,?-ненаситен алдехид, присъстващ в сълзотворен газ, изгорели газове на превозни средства или дим от горяща растителност (т.е. горски пожари и цигари). Акролеинът и други летливи дразнители (като хипохлорит, водороден пероксид, формалин и изоцианати) активират сензорните неврони, които инервират очите и дихателните пътища, причинявайки болка и възпаление (Bautista et al., 2008; Bessac and Jordt, 2009; Caceres et al. , 1). Това действие може да има особено тежки последици за тези, които страдат от астма, хронична кашлица или други белодробни заболявания. Мишките без TRPA2009 показват силно намалена чувствителност към такива агенти, подчертавайки критичната природа на този канал като сензорен детектор на реактивни дразнители на околната среда (Caceres et al., 1). В допълнение към тези токсини от околната среда, TRPA2006 е насочен към някои общи анестетици (като изофлуоран) или метаболитни странични продукти на химиотерапевтични агенти (като циклофосфамид), което вероятно е в основата на някои от неблагоприятните странични ефекти на тези лекарства, включително остра болка и силно невровъзпаление (Bautista et al., 2008; Matta et al., XNUMX).
И накрая, химически дразнители и други про-алгетични агенти също се произвеждат ендогенно в отговор на увреждане на тъканите или физиологичен стрес, включително оксидативен стрес. Такива фактори могат да действат самостоятелно или в комбинация, за да сенсибилизират ноцицепторите към термични и/или механични стимули, като по този начин намаляват праговете на болка. Резултатът от това действие е засилване на предпазните и защитни рефлекси след нараняване. По този начин, химионоцицепцията представлява важен интерфейс между острата и персистираща болка, особено в контекста на нараняване и възпаление на периферната тъкан, както е обсъдено по-подробно по-долу.
Остра болка: Провеждане на сигнала за болка
След като термичните и механичните сигнали се трансдуцират от първичния аферентен терминал, рецепторният потенциал активира различни йонни канали, зависими от напрежението. Натриевите и калиеви канали с волтажно управление са от решаващо значение за генерирането на потенциали за действие, които предават ноцицепторни сигнали към синапсите в дорзалния рог. Волтаж-зависимите калциеви канали играят ключова роля в освобождаването на невротрансмитери от централните или периферните ноцицепторни терминали за генериране на болка или съответно неврогенно възпаление. Ние ограничаваме нашата дискусия до членове на семействата на натриевите и калциевите канали, които служат като мишени на използваните в момента аналгетични лекарства или за които човешката генетика поддържа роля в предаването на болка. Неотдавнашен преглед обсъжда важния принос на KCNQ калиеви канали, включително терапевтичната полза от увеличаване на активността на K+ каналите за лечение на персистираща болка (Brown and Passmore, 2009).
Натриеви канали с напрежение
Различни натриеви канали се експресират в соматосензорни неврони, включително тетродотоксин (TTX)-чувствителните канали Nav1.1, 1.6 и 1.7 и TTX-нечувствителните канали, Nav1.8 и 1.9. През последните години приносът на Nav1.7 е получил много внимание, тъй като променената активност на този канал води до различни човешки болкови разстройства (Cox et al., 2006; Dib-Hajj et al., 2008). Пациентите с мутации на загуба на функция в този ген не са в състояние да открият вредни стимули и в резултат на това страдат от наранявания поради липса на защитни рефлекси. За разлика от тях, редица мутации за усилване на функцията в Nav1.7 водят до свръхвъзбудимост на канала и са свързани с две отделни нарушения на болката при хората, еритромелалгия и пароксизмално екстремно болково разстройство, и двете от които причиняват интензивни усещания за парене (Estacion et al., 2008; Fertleman et al., 2006; Yang et al., 2004). Проучванията върху животни показват, че Nav1.7 е силно регулиран при различни модели на възпалителна болка. Всъщност анализът на мишки без Nav1.7 в C ноцицептори подкрепя ключова роля за този канал при механична и термична свръхчувствителност след възпаление и при остри отговори на вредни механични стимули (Nassar et al., 2004). Донякъде изненадващо, болката, предизвикана от увреждане на нерва, е непроменена, което предполага, че отделните подтипове на натриевите канали или друга популация от аференти, експресиращи Nav1.7, допринасят за невропатичната болка (Nassar et al., 2005).
Натриевият канал Nav1.8 също е силно експресиран от повечето C ноцицептори. Както при Nav1.7 нокаут животни, тези без Nav1.8 показват скромни дефицити в чувствителността към безобидна или вредна топлина или безвреден натиск; те обаче показват отслабени отговори на вредни механични стимули (Akopian et al., 1999). Nav1.8 също е необходим за предаването на студени стимули, тъй като мишките без този канал са нечувствителни към студ в широк диапазон от температури (Zimmermann et al., 2007). Това е така, защото Nav1.8 е уникален сред чувствителните на напрежение натриеви канали по това, че не се инактивира при ниска температура, което го прави преобладаващият генератор на потенциал на действие при студени условия.
Интересно е, че трансгенните мишки без Nav1.8 експресираща подгрупа от сензорни неврони, които са били изтрити чрез целенасочена експресия на дифтериен токсин А (Abrahamsen et al., 2008), показват атенюирани отговори както на механични стимули с нисък и висок праг, така и на студ. В допълнение, механичната и термична свръхчувствителност при моделите на възпалителна болка е силно отслабена. Диференциалните фенотипове на мишки без Nav1.8 канали спрямо делеция на Nav1.8-експресиращи неврони вероятно отразяват приноса на множество зависими от напрежението подтипове натриеви канали към предаването на съобщения за болка.
Волтаж-зависимите натриеви канали са мишени на локални анестетици, което подчертава потенциала за разработване на специфични за подтип аналгетици. Nav1.7 е особено интересна цел за лечение на синдроми на възпалителна болка, отчасти, защото човешките генетични изследвания показват, че инхибиторите на Nav1.7 трябва да намалят болката, без да променят други основни физиологични процеси (вижте по-горе). Друго потенциално приложение на блокерите на натриевите канали може да бъде за лечение на екстремна свръхчувствителност към студ, особено обезпокоителен неблагоприятен страничен ефект на базираните на платина химиотерапевтици, като оксалиплатин (Attal et al., 2009). Nav1.8 (или TRPM8) антагонистите могат да облекчат тази или други форми на студена алодиния. И накрая, голямата полезност на антидепресантите инхибитори на обратното захващане на серотонин и норепинефрин за лечение на невропатична болка може всъщност да се дължи на способността им да блокират волтаж-зависимите натриеви канали (Dick et al., 2007).
Калциеви канали с напрежение
Различни волтаж-зависими калциеви канали се експресират в ноцицептори. Най-голямо внимание са получили N-, P/Q- и T-тип калциеви канали. P/Q-тип каналите се експресират в синаптичните терминали в ламини II-IV на дорзалния рог. Тяхната точна роля в ноцицепцията не е напълно разрешена. Въпреки това, мутациите в тези канали са свързани с фамилна хемиплегична мигрена (de Vries et al., 2009). N- и T-тип калциевите канали също се експресират от С-влакна и се регулират нагоре при патофизиологични състояния, както при модели на диабетна невропатия или след други форми на увреждане на нервите. Животните без Cav2.2 или 3.2 показват намалена чувствителност към механични или термични стимули съответно след възпаление или нараняване на нерв (Cao, 2006; Swayne and Bourinet, 2008; Zamponi et al., 2009; Messinger et al., 2009). Освен това, ?-конотоксин GVIA, който блокира N-тип канали, се прилага интратекално (като зиконотид), за да осигури облекчение на непреодолимата ракова болка (Rauck et al., 2009).
Всички калциеви канали са хетеромерни протеини, съставени от ?1 порообразуващи субединици и модулиращите субединици ?2?, ?2? или ?2?. ?2? субединица регулира плътността на тока и кинетиката на активиране и инактивиране. В C ноцицепторите ?2? субединицата се регулира драматично след увреждане на нерва и играе ключова роля в предизвиканата от нараняване свръхчувствителност и алодиния (Luo et al., 2001). Всъщност тази субединица е целта на габапентиноидния клас антиконвулсанти, които сега се използват широко за лечение на невропатична болка (Davies et al., 2007).
Постоянна болка: периферни механизми
Постоянната болка, свързана с нараняване или заболявания (като диабет, артрит или туморен растеж), може да е резултат от промени в свойствата на периферните нерви. Това може да се случи като следствие от увреждане на нервните влакна, което води до повишено спонтанно изстрелване или промени в техните проводими или невротрансмитерни свойства. Всъщност полезността на локални и дори системни локални анестетици за лечение на различни състояния на невропатична болка (като постхерпетична невралгия) вероятно отразява тяхното действие върху натриевите канали, които се натрупват в увредените нервни влакна.
Химическата среда на възпалението
Периферната сенсибилизация по-често е резултат от свързани с възпаление промени в химическата среда на нервните влакна (McMahon et al., 2008). По този начин, увреждането на тъканите често е придружено от натрупване на ендогенни фактори, освободени от активирани ноцицептори или не-невронни клетки, които се намират вътре или инфилтрират в увредената зона (включително мастоцити, базофили, тромбоцити, макрофаги, неутрофили, ендотелни клетки, кератиноцити и фибробласти). Колективно. тези фактори, наричани „възпалителна супа“, представляват широк спектър от сигнални молекули, включително невротрансмитери, пептиди (вещество P, CGRP, брадикинин), ейкозиноиди и свързани липиди (простагландини, тромбоксани, левкотриени, ендоканабининоиди), невроканабининоиди и хемокини, както и извънклетъчни протеази и протони. Забележително е, че ноцицепторите експресират един или повече рецептори на клетъчната повърхност, способни да разпознават и реагират на всеки от тези про-възпалителни или про-алгетични агенти (Фигура 4). Такива взаимодействия повишават възбудимостта на нервните влакна, като по този начин повишават чувствителността му към температура или допир.
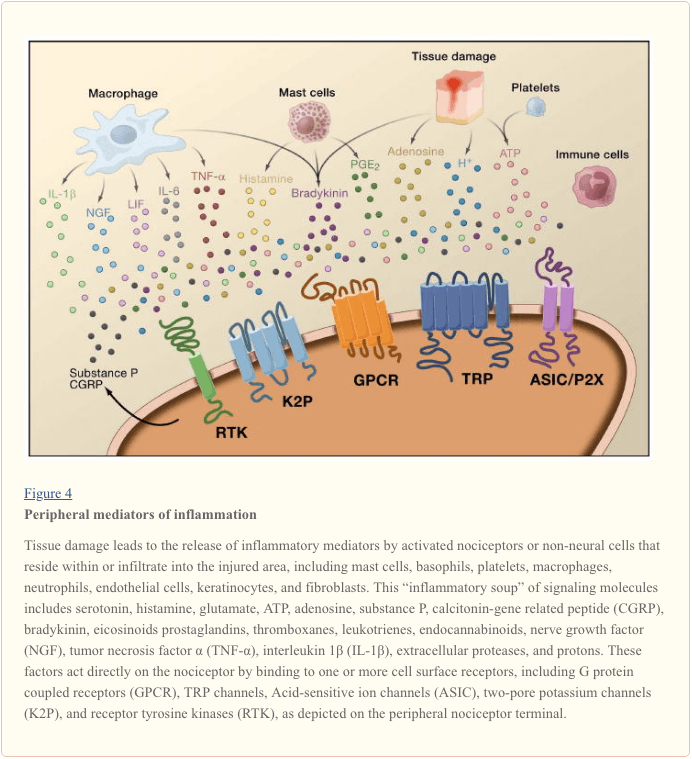
Безспорно най-често срещаният подход за намаляване на възпалителната болка включва инхибиране на синтеза или натрупването на компоненти на възпалителната супа. Това е най-добре илюстрирано от нестероидни противовъзпалителни лекарства, като аспирин или ибупрофен, които намаляват възпалителната болка и хипералгезията чрез инхибиране на циклооксигеназите (Cox-1 и Cox-2), участващи в синтеза на простагландин. Втори подход е да се блокират действията на възпалителни агенти в ноцицептора. Тук ние подчертаваме примери, които предоставят нов поглед върху клетъчните механизми на периферна сенсибилизация или които формират основата на нови терапевтични стратегии за лечение на възпалителна болка.
NGF е може би най-известен с ролята си на невротрофичен фактор, необходим за оцеляването и развитието на сензорните неврони по време на ембриогенезата, но при възрастни, NGF също се произвежда при увреждане на тъканите и представлява важен компонент на възпалителната супа (Ritner et. др., 2009). Сред многобройните си клетъчни мишени, NGF действа директно върху пептидергичните C влакна ноцицептори, които експресират високоафинитетната NGF рецепторна тирозин киназа, TrkA, както и невротрофиновия рецептор с нисък афинитет, p75 (Chao, 2003; Snider and McMahon, 1998). NGF произвежда дълбока свръхчувствителност към топлина и механични стимули чрез два временно различни механизма. Първоначално взаимодействието на NGF-TrkA активира сигнални пътища надолу по веригата, включително фосфолипаза С (PLC), митоген-активирана протеин киназа (MAPK) и фосфоинозитид 3-киназа (PI3K). Това води до функционално потенциране на целевите протеини в периферния ноцицепторен терминал, най-вече TRPV1, което води до бърза промяна в клетъчната и поведенческата топлинна чувствителност (Chuang et al., 2001). В допълнение към тези бързи действия, NGF също се транспортира ретроградно до ядрото на ноцицептора, където насърчава повишена експресия на про-ноцицептивни протеини, включително субстанция P, TRPV1 и Nav1.8 зависима от напрежение субединица на натриев канал (Chao, 2003; Ji et al., 2002). Заедно тези промени в генната експресия повишават възбудимостта на ноцицептора и усилват неврогенния възпалителен отговор.
В допълнение към невротрофините, нараняването насърчава освобождаването на множество цитокини, главният сред които интерлевкин 1? (IL-1?) и IL-6 и тумор некрозис фактор ? (TNF-?) (Ritner et al., 2009). Въпреки че има доказателства в подкрепа на прякото действие на тези цитокини върху ноцицепторите, техният основен принос към свръхчувствителността към болка е резултат от потенциране на възпалителния отговор и повишено производство на про-алгетични агенти (като простагландини, NGF, брадикинин и извънклетъчни протони).
Независимо от техните про-ноцицептивни механизми, намесата в сигнализирането на невротрофини или цитокини се превърна в основна стратегия за контролиране на възпалителното заболяване или произтичащата от това болка. Основният подход включва блокиране на NGF или TNF-? действие с неутрализиращо антитяло. В случая на TNF-?, това е забележително ефективно при лечението на множество автоимунни заболявания, включително ревматоиден артрит, което води до драматично намаляване както на разрушаването на тъканите, така и на съпътстващата хипералгезия (Atzeni et al., 2005). Тъй като основните действия на NGF върху възрастния ноцицептор се проявяват в условията на възпаление, предимството на този подход е, че хипералгезията ще намалее, без да засяга нормалното възприемане на болката. Наистина, анти-NGF антителата в момента са в клинични изпитвания за лечение на синдроми на възпалителна болка (Hefti et al., 2006).
Мишени на възпалителната супа
TRPV1. Силна свръхчувствителност към топлина може да се развие при възпаление или след инжектиране на специфични компоненти на възпалителната супа (като брадикинин или NGF). Липсата на такава сенсибилизация при мишки с дефицит на TRPV1 осигурява генетична подкрепа за идеята, че TRPV1 е ключов компонент от механизма, чрез който възпалението произвежда термична хипералгезия (Caterina et al., 2000; Davis et al., 2000). Всъщност, in vitro проучванията показват, че TRPV1 функционира като полимодален сигнален интегратор, чиято термична чувствителност може да бъде дълбоко модулирана от компонентите на възпалителната супа (Tominaga et al., 1998). Някои от тези възпалителни агенти (например, извънклетъчни протони и липиди) функционират като директни положителни алостерични модулатори на канала, докато други (брадикинин, ATP и NGF) се свързват със собствените си рецептори на първичните аференти и модулират TRPV1 чрез активиране на долния вътреклетъчен сигнални пътища. И в двата случая тези взаимодействия водят до дълбоко намаляване на прага на термично активиране на канала, както и до увеличаване на величината на отговорите при надпрагови температури - биофизичните еквиваленти на алодиния и хипералгезия, съответно.
Въпреки това, остават противоречия относно вътреклетъчните сигнални механизми, които са най-отговорни за модулацията на TRPV1 (Lumpkin and Caterina, 2007). Напомнящи на предците TRP канали в окото на мухата, много TRP канали при бозайници се активират или положително модулират от фосфолипаза С-медиирано разцепване на фосфатидил инозитол 4,5 бифосфат (PIP2) на плазмената мембрана. Разбира се, има много последици от това действие, включително намаляване на PIP2 в мембраната, повишаване на нивата на диацилглицерол и неговите метаболити, повишен цитоплазмен калций, както и последващо активиране на протеин кинази. В случая на TRPV1 повечето, ако не всички, от тези пътища са замесени в процеса на сенсибилизация и остава да се види кои са най-подходящи за поведенческата термична свръхчувствителност. Независимо от това, има широко съгласие, че модулацията на TRPV1 е от значение за свръхчувствителност към болка, предизвикана от увреждане на тъканите, особено в условията на възпаление. Това включва състояния като слънчево изгаряне, инфекция, ревматоиден или остеоартрит и възпалително заболяване на купата. Друг интересен пример включва болка от рак на костите (Honore et al., 2009), където туморният растеж и разрушаването на костите са придружени от изключително силна тъканна ацидоза, както и производство на цитокини, невротрофини и простагландини.
TRPA1. Както е описано по-горе, TRPA1 се активира от съединения, които образуват ковалентни адукти с цистеинови остатъци. В допълнение към токсините от околната среда, това включва ендогенни тиол-реактивни електрофили, които се произвеждат по време на нараняване и възпаление на тъканите или в резултат на оксидативен или нитративен стрес. Главни сред такива агенти са 4-хидрокси-2-ноненал и 15-деокси-а12,14-простагландин J2, които и двете са ?,? ненаситени алдехиди, генерирани чрез пероксидация или спонтанна дехидратация на липидни вторични носители (Andersson et al., 2008; Cruz-Orengo et al., 2008; Materazzi et al., 2008; Trevisani et al., 2007). Други ендогенни TRPA1 агонисти включват нитроолеинова киселина, водороден пероксид и сероводород. В допълнение към тези директно действащи агенти, TRPA1 също се модулира индиректно от про-алгетични агенти, като брадикинин, които действат чрез PLC-свързани рецептори. Всъщност мишките с дефицит на TRPA1 показват драстично намалени клетъчни и поведенчески реакции към всички тези агенти, както и намаляване на термичната и механична свръхчувствителност, предизвикана от увреждане на тъканите (Bautista et al., 2006; Kwan et al., 2006). И накрая, тъй като TRPA1 играе ключова роля в неврогенните и други възпалителни реакции както към ендогенни агенти, така и към летливи токсини от околната среда, неговият принос към възпалението на дихателните пътища, каквото се случва при астма, е от особен интерес. Всъщност генетичната или фармакологична блокада на TRPA1 намалява възпалението на дихателните пътища при модел на гризач на астма, предизвикана от алергени (Caceres et al., 2009).
ASIC. Както бе отбелязано по-горе, ASIC каналите са членове на семейството DEG/ENaC, които се активират чрез подкиселяване и по този начин представляват друго важно място за действието на извънклетъчните протони, произведени като следствие от увреждане на тъканите или метаболитен стрес. ASIC подтиповете могат да образуват различни хомомерни или хетеромерни канали, всеки от които има различна рН чувствителност и профил на експресия. Каналите, съдържащи подтипа ASIC3, са специално експресирани от ноцицептори и особено добре представени във влакна, които инервират скелетния и сърдечния мускул. В тези тъкани анаеробният метаболизъм води до натрупване на млечна киселина и протони, които активират ноцицепторите за генериране на мускулно-скелетна или сърдечна болка (Immke and McCleskey, 2001). Интересно е, че ASIC3-съдържащите канали се отварят в отговор на умереното намаляване на pH (напр. 7.4 до 7.0), което се случва при сърдечна исхемия (Yagi et al., 2006). Млечната киселина също така значително потенцира протонно-предизвиканото стробиране чрез механизъм, включващ хелиране на калций (Immke and McCleskey, 2003). По този начин, ASIC3-съдържащите канали откриват и интегрират сигнали, специфично свързани с мускулна исхемия и по този начин са функционално различни от други сензори за киселина на първичния аферент, като TRPV1 или други подтипове на ASIC канали.
Постоянна болка: централни механизми
Централната сенсибилизация се отнася до процеса, чрез който се установява състояние на свръхвъзбудимост в централната нервна система, което води до засилена обработка на ноцицептивни (болкови) съобщения (Woolf, 1983). Въпреки че множество механизми са замесени в централната сенсибилизация, тук се фокусираме върху три: промяна в глутаматергичната невротрансмисия/медиирана от NMDA рецептор свръхчувствителност, загуба на тонични инхибиторни контроли (дезинхибиране) и глиално-невронни взаимодействия (Фигура 5).
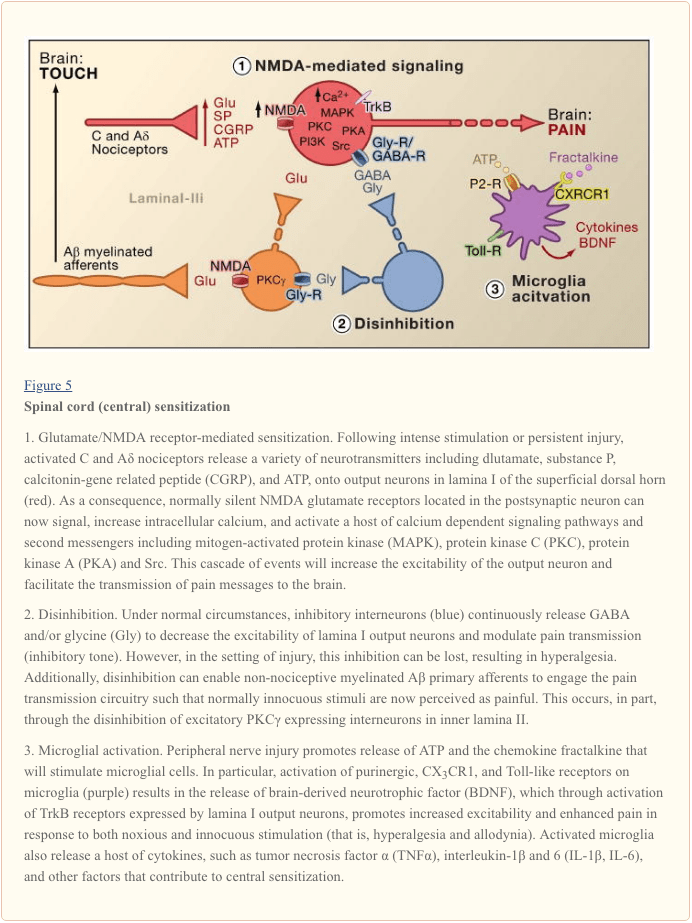
Сенсибилизация, медиирана от глутамат/NMDA рецептор
Острата болка се сигнализира от освобождаването на глутамат от централните терминали на ноцицепторите, генериращи възбуждащи постсинаптични токове (EPSCs) в невроните на дорзалния рог от втори ред. Това се случва главно чрез активиране на постсинаптичните AMPA и каинатни подтипове на йонотропните глутаматни рецептори. Сумирането на подпраговите EPSCs в постсинаптичния неврон в крайна сметка ще доведе до изстрелване на потенциала на действие и предаване на съобщението за болка към неврони от по-висок порядък. При тези условия, NMDA подтипът на глутаматния канал е безшумен, но при нараняване, повишеното освобождаване на невротрансмитери от ноцицепторите ще деполяризира в достатъчна степен постсинаптичните неврони, за да активира неподвижни NMDA рецептори. Последващото увеличаване на притока на калций може да засили синаптичните връзки между ноцицепторите и невроните за предаване на болка в дорзалния рог, което от своя страна ще изостри отговорите на вредни стимули (тоест, генерира хипералгезия).
В много отношения този процес е сравним с този, свързан с пластичните промени, свързани с дългосрочното потенциране на хипокампа (LTP) (за преглед на LTP в пътя на болката, вижте Drdla и Sandkuhler, 2008). Всъщност лекарствата, които блокират гръбначния LTP, намаляват хипералгезията, причинена от увреждане на тъканите. Както в случая на хипокампалния LTP, централната сенсибилизация на гръбначния мозък зависи от NMDA-медиирано повишение на цитозолния Ca2+ в постсинаптичния неврон. Едновременното активиране на метаботропен глутамат и субстанция Р рецептори на постсинаптичния неврон може също да допринесе за сенсибилизация чрез увеличаване на цитозолния калций. Активирането надолу по веригата на множество сигнални пътища и вторични предавателни системи, по-специално кинази (като MAPK, PKA, PKC, PI3K, Src), допълнително повишава възбудимостта на тези неврони, отчасти чрез модулиране на функцията на NMDA рецептора (Latremoliere and Woolf, 2009) . Илюстративно за този модел е демонстрацията, че гръбначните инжекции на пептиден фрагмент от девет аминокиселини на Src не само нарушават взаимодействието на NMDA рецептор-Src, но също така значително намаляват свръхчувствителността, произведена от периферно нараняване, без да променят острата болка. Src нулеви мутантни мишки също показват намалена механична алодиния след увреждане на нерва (Liu et al., 2008).
В допълнение към засилването на входа от мястото на нараняване (първична хипералгезия), централната сенсибилизация допринася за състоянието, при което безвредно стимулиране на области около мястото на нараняване може да предизвика болка. Тази вторична хипералгезия включва хетеросинаптично улесняване, при което входните данни от A? аферентите, които обикновено реагират на леко докосване, сега включват вериги за предаване на болка, което води до дълбока механична алодиния. Фактът, че компресионният блок на периферните нервни влакна едновременно прекъсва проводимостта в A? аферентите и елиминира вторичната хипералгезия показва, че тези анормални вериги са установени в клинични условия, както и в животински модели (Campbell et al., 1988).
Загуба на GABAergic и Glycinergic контроли: Дезинхибиране
ГАМКергичните или глицинергичните инхибиторни интерневрони са гъсто разпределени в повърхностния дорсален рог и са в основата на дългогодишната теория за контрол на болката, която постулира, че загубата на функция на тези инхибиторни интерневрони (дезинхибиране) би довела до повишена болка (Melzack и Wall, 1965 г.). Действително, при гризачи гръбначното приложение на рецепторни антагонисти на GABA (бикукулин) или глицин (стрихнин) (Malan et al., 2002; Sivilotti and Woolf, 1994; Yaksh, 1989) предизвиква поведенческа свръхчувствителност, наподобяваща тази, наблюдавана след периферни В съответствие с тези наблюдения, периферното нараняване води до намаляване на инхибиторните постсинаптични токове в невроните на повърхностния дорзален рог. Въпреки че Moore et al. (2002) предполагат, че деинхибирането е резултат от смърт на GABAergic интерневрони, предизвикана от увреждане на периферните нерви, това твърдение е оспорено (Polgar et al., 2005). Независимо от етиологията, полученото намалено тонично инхибиране засилва деполяризацията и възбуждането на проекционните неврони. Що се отнася до NMDA-медиираната централна сенсибилизация, дезинхибирането повишава изхода на гръбначния мозък в отговор на болезнена и неболезнена стимулация, допринасяйки за механична алодиния (Keller et al., 2007; Torsney and MacDermott, 2006).
След по-ранен доклад, че изтриването на гена, кодиращ PKC? при мишката води до значително намаляване на механичната свръхчувствителност, предизвикана от увреждане на нервите (Malmberg et al., 1997), последните проучвания разглеждат участието на тези неврони в дезинхибиторния процес. По този начин, след блокиране на глицинергичното инхибиране със стрихнин, безобидното разресване на задната лапа активира PKCa-позитивните интерневрони в ламина II (Miraucourt et al., 2007), както и проекционните неврони в ламина I. Тъй като PKCa-позитивните неврони гръбначния мозък са разположени само в най-вътрешната част на ламина II (Фигура 1), от това следва, че тези неврони са от съществено значение за експресията на постоянна болка, предизвикана от увреждане на нервите, и че дезинхибиторните механизми водят до тяхното хиперактивиране.
Други проучвания показват, че промените в проекционния неврон сами по себе си допринасят за де-инхибиторния процес. Например, увреждането на периферния нерв дълбоко регулира надолу K+-Cl- ко-транспортера KCC2, който е от съществено значение за поддържане на нормални K+ и Cl- градиенти през плазмената мембрана (Coull et al., 2003). Понижаването на KCC2, който се експресира в невроните на ламина I проекция, води до изместване на Cl-градиента, така че активирането на GABA-A рецепторите деполяризира, а не хиперполяризира невроните на проекцията на ламина I. Това от своя страна ще повиши възбудимостта и ще увеличи предаването на болката. Действително, фармакологичната блокада или siRNA-медиираната регулация на KCC2 при плъхове предизвиква механична алодиния. Независимо от това, Zeilhofer и колегите предполагат, че дори след нараняване, остава достатъчен инхибиторен тонус, така че подобряването на спиналната GABAergic невротрансмисия може да бъде ценен подход за намаляване на свръхчувствителността към болката, предизвикана от увреждане на периферните нерви (Knabl et al., 2008). Всъщност, проучвания при мишки предполагат, че лекарствата, насочени специално към GABAA комплекси, съдържащи ?2 и/или ?3 субединици, намаляват възпалителната и невропатичната болка, без да предизвикват седативно-хипнотични странични ефекти, типично свързани с бензодиазепините, които повишават активността на ?1-съдържащите канали.
Дезинхибирането може да настъпи и чрез модулиране на глицинергичната сигнализация. В този случай механизмът включва действието на простагландините в гръбначния мозък (Harvey et al., 2004). По-конкретно, увреждането на тъканта предизвиква освобождаване на гръбначния стълб на простагландина, PGE2, който действа върху ЕР2 рецепторите, експресирани от възбуждащи интерневрони и проекционни неврони в повърхностния гръбен рог. Получената стимулация на пътя на cAMP-PKA фосфорилира GlyRa3 глицин рецепторни субединици, което прави невроните неотзивчиви към инхибиторните ефекти на глицина. Съответно, мишки без ген GlyRa3 имат намалена топлинна и механична свръхчувствителност при модели на увреждане на тъканите.
Глиално-невронни взаимодействия
И накрая, глиалните клетки, по-специално микроглията и астроцитите, също допринасят за централния процес на сенсибилизация, който се случва в условията на нараняване. При нормални условия микроглията функционира като резидентни макрофаги на централната нервна система. Те са хомогенно разпределени в сивото вещество на гръбначния мозък и се предполага, че функционират като стражи на нараняване или инфекция. В рамките на часове след нараняване на периферния нерв обаче, микроглия се натрупва в повърхностния гръбен рог в рамките на зоната на завършване на увредените периферни нервни влакна. Микроглията също заобикаля клетъчните тела на мотоневроните на вентралния рог, чиито периферни аксони са увредени едновременно. Активираната микроглия освобождава множество сигнални молекули, включително цитокини (като TNF-a, интерлевкин-1a и 6), които повишават централната сенсибилизация на невроните и индуцирана от нервно увреждане персистираща болка (DeLeo et al., 2007). Всъщност, инжектирането на активирана мозъчна микроглия в церебралната гръбначна течност на нивото на гръбначния мозък може да възпроизведе поведенческите промени, наблюдавани след увреждане на нерва (Coull et al., 2005). По този начин изглежда, че микроглиалното активиране е достатъчно, за да предизвика състояние на персистираща болка (Tsuda et al., 2003).
Тъй като микроглиите се активират след увреждане на нерв, но не и възпалително тъканно увреждане, от това следва, че активирането на аферентното влакно, което се случва и при двете състояния на нараняване, не е критичният тригер за микроглиално активиране. По-скоро физическото увреждане на периферния аферент трябва да предизвика освобождаването на специфични сигнали, които се откриват от микроглия. Главен сред тях е АТФ, който е насочен към микроглиални P2-тип пуринергични рецептори. Особен интерес представляват P2X4 (Tsuda et al., 2003), P2X7 (Chessell et al., 2005) и P2Y12 (Haynes et al., 2006; Kobayashi et al., 2008) рецепторни подтипове. Наистина, АТФ се използва за активиране на мозъчна микроглия в изследванията за трансплантация на гръбначния мозък, посочени по-горе (Tsuda et al., 2003). Освен това, генетичната или фармакологична блокада на функцията на пуринергичните рецептори (Chessell et al., 2005; Tozaki-Saitoh et al., 2008; Ulmann et al., 2008) предотвратява или обръща индуцирана от увреждане на нервите механична алодиния (Honore et al., 2006, 2008, 2008, 2003). ; Kobayashi et al., XNUMX; Tozaki-Saitoh et al., XNUMX; Tsuda et al., XNUMX).
Coull и колеги предложиха модел, при който ATP/P2X4-медиирано активиране на микроглия задейства механизъм на деинхибиране (Coull et al., 2005). По-конкретно, те демонстрираха, че АТФ-предизвиканото активиране на P2X4 рецепторите предизвиква освобождаване на невротрофичен фактор, получен от мозъка (BDNF) от микроглия. BDNF, от своя страна, действа върху TrkB рецепторите върху невроните на проекцията на ламина I, за да генерира промяна в Cl-градиента, която, както е описано по-горе, би изместила действието на GABA от хиперполяризация към деполяризация. Не е известно дали BDNF-индуцираният ефект включва експресия на KCC2, както се случва след увреждане на нерва. Независимо от механизма, крайният резултат е, че активирането на микроглия ще сенсибилизира невроните на ламината I, така че техният отговор на моносинаптични входове от ноцицептори или индиректни входове от A? аферентни, се засилва.
В допълнение към BDNF, активираната микроглия, подобно на периферните макрофаги, освобождава и реагира на множество хемокини и цитокини, и те също допринасят за централната сенсибилизация. Например, при неувреденото (нормално) животно, хемокиновият фракталкин (CXCL1) се експресира както от първични аференти, така и от неврони на гръбначния мозък (Lindia et al., 2005; Verge et al., 2004; Zhuang et al., 2007). Обратно, рецепторът на фракталкин (CX3CR1) се експресира върху микроглиални клетки и, което е важно, се регулира нагоре след увреждане на периферните нерви (Lindia et al., 2005; Zhuang et al., 2007). Тъй като гръбначното доставяне на фракталкин може да активира микроглия, изглежда, че индуцираното от увреждане на нервите освобождаване на фракталкин осигурява още един път, чрез който микроглията може да бъде ангажирана в процеса на централна сенсибилизация. Всъщност блокадата на CX3CR1 с неутрализиращо антитяло предотвратява както развитието, така и поддържането на индуцирана от нараняване персистираща болка (Milligan et al., 2004; Zhuang et al., 2007). Този път може също да бъде част от положителна обратна връзка, чрез която увредените нервни влакна и микроглиалните клетки взаимодействат по реципрочен и повтарящ се начин, за да усилят сигналите за болка. Тази точка се подчертава от факта, че фракталкинът трябва да бъде отцепен от невронната повърхност преди сигнализиране, действие, което се осъществява от протеаза, извлечена от микроглии, катепсин S, чиито инхибитори намаляват алодиния и хипералгезия, причинени от увреждане на нервите (Clark et. др., 2007). Важно е, че гръбначното приложение на катепсин S генерира поведенческа свръхчувствителност при див тип, но не и при CX3CX1 нокаут мишки, свързвайки катепсин S с фракталкинова сигнализация (Clark et al., 2007; Zhuang et al., 2007). Въпреки че факторът(ите), който инициира освобождаването на катепсин S от микроглия, остава да бъде определен. ATP изглежда разумна възможност.
Съвсем наскоро няколко членове от семейството на Toll-подобни рецептори (TLRs) също бяха замесени в активирането на микроглия след увреждане на нерва. TLRs са трансмембранни сигнални протеини, експресирани в периферни имунни клетки и глия. Като част от вродената имунна система, те разпознават молекули, които са широко споделени от патогени. Генетичното или фармакологичното инхибиране на функцията TLR2, TLR3 или TLR4 при мишки води не само до намалена микроглиална активация, но също така намалява свръхчувствителността, предизвикана от увреждане на периферните нерви (Kim et al., 2007; Obata et al., 2008; Tanga et al. , 2005). Неизвестни са ендогенните лиганди, които активират TLR2-4 след увреждане на нерва. Сред кандидатите са иРНК или протеини от топлинен шок, които биха могли да изтекат от увредените първични аферентни неврони и да дифундират в извънклетъчната среда на гръбначния мозък.
Приносът на астроцитите към централната сенсибилизация е по-малко ясен. Астроцитите несъмнено се индуцират в гръбначния мозък след нараняване на тъкан или нерв (за преглед вижте Ren and Dubner, 2008). Но, за разлика от микроглията, активирането на астроцитите обикновено се забавя и продължава много по-дълго, до няколко месеца. Една интересна възможност е, че астроцитите са по-критични за поддържането, а не за индуцирането на централна сенсибилизация и постоянна болка.
И накрая, заслужава да се отбележи, че периферното нараняване не само активира глията в гръбначния мозък, но и в мозъчния ствол, където глията допринася за супраспинални улесняващи влияния върху обработката на съобщения за болка в гръбначния мозък (виж фигура 2), феномен, наречен низходящо улеснение (за преглед вижте Ren and Dubner, 2008). Такова улесняване е особено забележимо в обстановката на нараняване и изглежда противодейства на инхибиторните контроли на обратната връзка, които едновременно възникват от различни локуси на мозъчния ствол (Porreca et al., 2002).

Прозрение на д-р Алекс Химензе
Както е установено от Международната асоциация за изследване на болката или IASP, болката е „неприятно сетивно и емоционално преживяване, свързано с остро или потенциално увреждане на тъканите, или описано като увреждане на тъканта или и двете. Предложени са множество изследователски проучвания, които да демонстрират физиологичната основа на болката, но нито едно не е в състояние да включи всички аспекти, свързани с възприемането на болката. Разбирането на механизмите на болка при острата болка срещу хроничната болка е от основно значение по време на клиничните оценки, тъй като това може да помогне за определяне на най-добрия подход за лечение на пациенти с основни здравословни проблеми.
Специфичност при предаването и контрола на съобщенията за болка
Разбирането как стимулите се кодират от нервната система, за да предизвикат подходящо поведение, е от основно значение за изучаването на всички сензорни системи. В най-простата форма, сензорната система използва маркирани линии за трансдуциране на стимули и предизвикване на поведение чрез строго сегрегирани вериги. Това може би е най-добре илюстрирано от вкусовата система, където размяната на сладък рецептор за горчив в популация от „аферентни на сладък вкус“ не променя поведението, провокирано от активността в тази белязана линия; при тези условия горчивият вкус стимулира тези аференти да предизвикат усещане за сладост (Mueller et al., 2005).
В пътя на болката също има доказателства в подкрепа на съществуването на маркирани линии. Както бе споменато по-горе, топлината и студът се откриват от до голяма степен различни подгрупи от първични аферентни влакна. Освен това, елиминирането на подгрупи от ноцицептори може да доведе до селективни дефицити в поведенческия отговор към определена вредна модалност. Например, унищожаването на TRPV1-експресиращи ноцицептори води до дълбока загуба на топлинна болка (включително топлинна хипералгезия), без промяна в чувствителността към болезнени механични или студени стимули. Обратно, изтриването на подгрупата на ноцицептори на MrgprD води до силно селективен дефицит в механичната реакция, без промяна в топлинната чувствителност (Cavanaugh et al., 2009). Допълнителни доказателства за функционална сегрегация на ниво ноцицептор идват от анализа на два различни подтипа на опиоидни рецептори (Scherrer et al., 2009). По-конкретно, мю опиоидният рецептор (MOR) преобладава в пептидергичната популация, докато делта опиоидният рецептор (DOR) се експресира в непептидергични ноцицептори. MOR-селективните агонисти блокират топлинната болка, докато DOR селективните агонисти блокират механичната болка, отново илюстрирайки функционалното разделяне на молекулярно различни популации от ноцицептори.
Тези наблюдения се аргументират за специфичност, свързана с поведението на нивото на ноцицептора. Това обаче вероятно ще бъде прекалено опростяване поне по две причини. Първо, много ноцицептори са полимодални и следователно могат да бъдат активирани от термични, механични или химични стимули, оставяйки човек да се чуди как елиминирането на големи групи ноцицептори може да има специфични за модалността ефекти. Това е аргумент за значителен принос на гръбначните вериги към процеса, при който ноцицептивните сигнали се кодират в различни модалности на болка. Всъщност важна бъдеща цел е да се очертаят по-добре невронните подтипове в дорзалния рог и да се характеризират техните синаптични взаимодействия с функционално или молекулярно дефинирани субпопулации от ноцицептори. Второ, системата за болка показва огромен капацитет за промяна, особено в обстановката на нараняване, повдигайки въпроси за това дали и как една етикетирана линейна система може да побере такава пластичност и как промените в такива механизми са в основата на неадаптивните промени, които произвеждат хронична болка. Наистина, ние знаем, че субстанция P-сапорин-медиирана делеция на дискретна популация от неврони на гръбначния рог на ламина I, които експресират рецептора на веществото P, може да намали както термичната, така и механичната свръхчувствителност към болка, която възниква след увреждане на тъкани или нерви (Nichols et al. ., 1999). Такива наблюдения предполагат, че при настройката на нараняване специфичността на маркираната линия не се поддържа стриктно, тъй като информацията се предава на по-високи нива на невроксиса.
Ясно е, че отговорите на тези въпроси ще изискват комбинирано използване на анатомични, електрофизиологични и поведенчески методи за картографиране на физическата и функционалната верига, която е в основата на ноцицепцията и болката. Текущата идентификация на молекули и гени, които маркират специфични невронни клетъчни типове (както периферни, така и централни) осигурява основни инструменти, с които да се манипулират генетично или фармакологично тези неврони и да се свържат техните дейности със специфични компоненти на поведението на болка при нормални и патофизиологични обстоятелства. Това трябва да ни доближи до разбирането как острата болка отстъпва място на неадаптивните промени, които произвеждат хронична болка, и как това превключване може да бъде предотвратено или обърнато.

Коноп срещу марихуана: Каква е разликата?
Тъй като приблизително половината от американските щати вече разрешават продажбата на медицинска марихуана, а няколко дори разрешават продажбата на марихуана за развлекателна употреба, все повече хора се интересуват от възможните ползи за здравето от това противоречиво растение.
Докато науката за медицинската му употреба продължава да напредва, много хора в наши дни обмислят как да получат достъп до ползите за здравето на растението, без да изпитват добре познатия му нежелан психоактивен ефект. Това е напълно възможно с близък роднина на марихуаната, коноп, но е от съществено значение да сте наясно с разликата, за да сте умен потребител.
Един сорт от точно същото растение
По принцип и конопът, и марихуаната са едно и също растение: Cannabis sativa. Има доказателства, че Cannabis sativa L е отглеждан в Азия преди хиляди години за своите фибри, както и за храна. Хората в крайна сметка осъзнаха, че цъфтящите върхове на растението имат психоактивни свойства. С течение на времето, както хората направиха това с много други растения, фермерите на канабис започнаха да култивират специфични растения, за да подобрят специфични свойства.
В днешно време, въпреки че някои биха могли да спорят за истинския брой видове растения, наистина има две прости разлики,
Коноп – Растение, култивирано предимно извън Съединените щати, въпреки че няколко държави в САЩ го позволяват да се отглежда за учебни цели) за използване в дрехи, хартия, биогорива, биопластмаси, хранителни добавки, козметика и храни. Конопът се култивира на открито като голяма култура, като присъстват както мъжки, така и женски растения, за да се стимулира опрашването и да се подобри производството на семена. Законно внесеният индустриален коноп съдържа по-малко от 0.3 процента от съдържанието на канцерогенен химичен тетрахидроканабинол или THC. В действителност законно внесеният коноп обикновено специално елиминира всички екстракти в изсушените цъфтящи върхове на растението.
марихуана (марихуана) – Cannabis sativa, специално култивирана, за да повиши съдържанието си на THC, за да се използва за медицински или развлекателни цели. Растенията на марихуана обикновено се отглеждат на закрито, при контролирани условия и производителите елиминират всички мъжки растения от реколтата, за да предотвратят оплождането, тъй като торенето понижава степента на THC на растението.
Законност на медицинската марихуана
Медицинската употреба на марихуана е засилена област на противоречия както за изследователите, така и за потребителите. Въпреки че може би не половината от американските щати са легализирали медицинската употреба на това растение, то остава незаконно според федералния закон и следователно употребата му остава спорна, независимо от факта, че изглежда има реални ползи за здравето при различни сериозни здравословни проблеми.
Тези, които искат да използват марихуана за медицинска употреба, трябва да говорят за нейните ползи срещу опасностите с квалифициран медицински специалист, преди да я използват. В допълнение, много потребители, които се интересуват от неговите ползи за здравето, не се нуждаят от психоактивните странични ефекти на THC или опасността от положителен тест за наркотици.
Коноп: Ползи за здравето без рискове
Вносният коноп, който има много ниско, почти липсващо ниво на THC, може да бъде решение за потребителите, които търсят ползите за здравето на растението минус ефектите на THC.
Въпреки че THC има някои ползи за здравето, конопът съдържа повече от 80 биоактивни съединения, които биха могли да осигурят отлична подкрепа за редица здравословни проблеми, като реакция на стрес, положително настроение и физически дискомфорт или болка. Конопът може също да е от полза за здравето на стомашно-чревния тракт, да помогне за поддържане на здравословен възпалителен отговор в цялото тяло и да поддържа нормалната имунна функция.
Ако обмисляте използването на хранителна добавка, която включва коноп, тогава е идеално да закупите продукт от доверен източник.
В заключение, както периферната, така и централната нервна система откриват, интерпретират и регулират широк спектър от термични и механични стимули, както и екологични и ендогенни химически дразнители. Ако стимулите са твърде интензивни, това може да предизвика остра болка, където в случай на постоянна или хронична болка предаването на болката може да бъде значително засегнато. Статията по-горе описва клетъчните и молекулярните механизми на болката за насоки при клинични оценки. Освен това, употребата на коноп може да има много ползи за здравето в сравнение със противоречивите ефекти на марихуаната. Информация, посочена от Националния център за биотехнологична информация (NCBI). Обхватът на нашата информация е ограничен до хиропрактика, както и до наранявания и състояния на гръбначния стълб. За да обсъдите темата, моля не се колебайте да попитате д-р Хименес или да се свържете с нас на 915-850-0900 .
Подготвен от д-р Алекс Хименес
Abrahamsen B, Zhao J, Asante CO, Cendan CM, Marsh S, Martinez-Barbera JP, Nassar MA, Dickenson AH, Wood JN. Клетъчната и молекулярната основа на механичната, студена и възпалителна болка. наука. 2008;321:702–705. [PubMed]
Акопян AN, Souslova V, England S, Okuse K, Ogata N, Ure J, Smith A, Kerr BJ, McMahon SB, Boyce S, et al. Резистентният на тетродотоксин натриев канал SNS има специализирана функция в пътищата на болка. Nat Neurosci. 1999;2:541–548. [PubMed]
Alessandri-Haber N, Dina OA, Joseph EK, Reichling D, Levine JD. Преходен рецепторен потенциал ванилоиден 4-зависим механизъм на хипералгезия се включва чрез съгласувано действие на възпалителни медиатори. J Neurosci. 2006;26:3864–3874. [PubMed]
Andersson DA, Gentry C, Moss S, Bevan S. Преходен рецепторен потенциал A1 е сензорен рецептор за множество продукти на оксидативен стрес. J Neurosci. 2008;28:2485–2494. [Безплатна статия за PMC] [PubMed]
Апкарян AV, Bushnell MC, Treede RD, Zubieta JK. Човешки мозъчни механизми за възприемане и регулиране на болката при здраве и болест. Eur J Pain. 2005;9:463–484. [PubMed]
Attal N, Bouhassira D, Gautron M, Vaillant JN, Mitry E, Lepere C, Rougier P, Guirimand F. Термална хипералгезия като маркер за невротоксичност на оксалиплатин: проспективно количествено изследване за сензорна оценка. Болка. 2009;144:245–252. [PubMed]
Atzeni F, Turiel M, Capsoni F, Doria A, Meroni P, Sarzi-Puttini P. Автоимунитет и анти-TNF-алфа агенти. Ann NY Acad Sci. 2005;1051:559–569. [PubMed]
Bandell M, Story GM, Hwang SW, Viswanath V, Eid SR, Petrus MJ, Earley TJ, Patapoutian A. Вредният студен йонен канал TRPA1 се активира от остри съединения и брадикинин. неврон. 2004;41:849–857. [PubMed]
Basbaum AI, Jessell T. Възприятието на болката. В: Kandel ER, Schwartz J, Jessell T, редактори. Принципи на невронауката. Ню Йорк: Апълтън и Ланге; 2000. С. 472–491.
Bautista DM, Jordt SE, Nikai T, Tsuruda PR, Read AJ, Poblete J, Yamoah EN, Basbaum AI, Julius D. TRPA1 медиира възпалителните действия на дразнители на околната среда и проалгетични агенти. клетка. 2006;124:1269–1282. [PubMed]
Bautista DM, Siemens J, Glazer JM, Tsuruda PR, Basbaum AI, Stucky CL, Jordt SE, Julius D. Ментоловият рецептор TRPM8 е основният детектор на студа в околната среда. природата. 2007;448:204–208. [PubMed]
Bautista DM, Sigal YM, Milstein AD, Garrison JL, Zorn JA, Tsuruda PR, Nicoll RA, Julius D. Остри агенти от сечуанските чушки възбуждат сензорните неврони чрез инхибиране на двупорови калиеви канали. Nat Neurosci. 2008;11:772–779. [Безплатна статия за PMC] [PubMed]
Bessac BF, Jordt SE. Спиращи дъха TRP канали: TRPA1 и TRPV1 при хемосензация на дихателните пътища и контрол на рефлекса. Физиология (Bethesda) 2008;23:360–370. [Безплатна статия за PMC] [PubMed]
Bhattacharya MR, Bautista DM, Wu K, Haeberle H, Lumpkin EA, Julius D. Радиалното разтягане разкрива различни популации от механочувствителни соматосензорни неврони на бозайници. Proc Natl Acad Sci US A. 2008;105:20015–20020. [Безплатна статия за PMC] [PubMed]
Браун DA, Passmore GM. Невронни KCNQ (Kv7) канали. Br J Pharmacol. 2009;156:1185–1195. [Безплатна статия за PMC] [PubMed]
Bryant BP, Mezine I. Алкиламидите, които предизвикват изтръпване на парестезия, активират тактилни и термични тригеминални неврони. Brain Res. 1999;842:452–460. [PubMed]
Caceres AI, Brackmann M, Elia MD, Bessac BF, del Camino D, D'Amours M, Witek JS, Fanger CM, Chong JA, Hayward NJ и др. Сензорен невронален йонен канал, важен за възпаление на дихателните пътища и хиперреактивност при астма. Proc Natl Acad Sci US A. 2009;106:9099–9104. [Безплатна статия за PMC] [PubMed]
Campbell JN, Raja SN, Meyer RA, Mackinnon SE. Миелинизирани аференти сигнализират за хипералгезия, свързана с увреждане на нерва. Болка. 1988;32:89–94. [PubMed]
Цао YQ. Волтаж-зависими калциеви канали и болка. Болка. 2006;126:5–9. [PubMed]
Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Нарушена ноцицепция и усещане за болка при мишки без капсаицин рецептор. наука. 2000;288:306–313. [PubMed]
Caterina MJ, Rosen TA, Tominaga M, Brake AJ, Julius D. Капсаицин-рецепторен хомолог с висок праг за вредна топлина. природата. 1999;398:436–441. [PubMed]
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Капсаициновият рецептор: топлинно активиран йонен канал в пътя на болката. природата. 1997;389:816–824. [PubMed]
Cavanaugh DJ, Lee H, Lo L, Shields SD, Zylka MJ, Basbaum AI, Anderson DJ. Различни подгрупи от немиелинизирани първични сензорни влакна медиират поведенчески реакции на вредни термични и механични стимули. Proc Natl Acad Sci US A. 2009;106:9075–9080. [Безплатна статия за PMC] [PubMed]
Cesare P, McNaughton P. Нов топлинно активиран ток в ноцицептивните неврони и неговата сенсибилизация от брадикинин. Proc Natl Acad Sci US A. 1996;93:15435–15439. [Безплатна статия за PMC] [PubMed]
Чалфи М. Невросензорна механотрансдукция. Nat Rev Mol Cell Biol. 2009;10:44–52. [PubMed]
Chao MV. Невротрофините и техните рецептори: точка на конвергенция за много сигнални пътища. Nat Rev Neurosci. 2003;4:299–309. [PubMed]
Чен Л., Хуанг Л.Й. Протеин киназа С намалява Mg2+ блока на NMDA-рецепторните канали като механизъм на модулация. природата. 1992;356:521–523. [PubMed]
Чен Х, Алесандри-Хабер Н, Левайн JD. Изразено затихване на индуцирана от възпалителни медиатори сенсибилизация на C-влакна за механични и хипотонични стимули при TRPV4-/- мишки. Mol Pain. 2007;3:31. [Безплатна статия за PMC] [PubMed]
Chessell IP, Hatcher JP, Bountra C, Michel AD, Hughes JP, Green P, Egerton J, Murfin M, Richardson J, Peck WL и др. Разрушаването на P2X7 пуринорецепторния ген премахва хроничната възпалителна и невропатична болка. Болка. 2005;114:386–396. [PubMed]
Cho H, Koo JY, Kim S, Park SP, Yang Y, Oh U. Нов механочувствителен канал, идентифициран в сензорните неврони. Eur J Neurosci. 2006;23:2543–2550. [PubMed]
Cho H, Shin J, Shin CY, Lee SY, Oh U. Механочувствителни йонни канали в култивирани сензорни неврони на неонатални плъхове. J Neurosci. 2002;22:1238–1247. [PubMed]
Chuang HH, Prescott ED, Kong H, Shields S, Jordt SE, Basbaum AI, Chao MV, Julius D. Bradykinin и факторът на растеж на нервите освобождават капсаициновия рецептор от PtdIns(4,5)P2-медиирано инхибиране. природата. 2001;411:957–962. [PubMed]
Chung MK, Lee H, Caterina MJ. Топлите температури активират TRPV4 в миши 308 кератиноцити. J Biol Chem. 2003;278:32037–32046. [PubMed]
Кларк AK, Yip PK, Grist J, Gentry C, Staniland AA, Marchand F, Dehvari M, Wotherspoon G, Winter J, Ullah J и др. Инхибиране на гръбначния микроглиален катепсин S за обръщане на невропатичната болка. Proc Natl Acad Sci US A. 2007;104:10655–10660. [Безплатна статия за PMC] [PubMed]
Colburn RW, Lubin ML, Stone DJ, Jr, Wang Y, Lawrence D, D'Andrea MR, Brandt MR, Liu Y, Flores CM, Qin N. Отслабена студена чувствителност при TRPM8 нулеви мишки. неврон. 2007;54:379–386. [PubMed]
Coull JA, Beggs S, Boudreau D, Boivin D, Tsuda M, Inoue K, Gravel C, Salter MW, De Koninck Y. BDNF от микроглия причинява изместване в градиента на невронния анион, лежащ в основата на невропатичната болка. природата. 2005;438:1017–1021. [PubMed]
Coull JA, Boudreau D, Bachand K, Prescott SA, Nault F, Sik A, De Koninck P, De Koninck Y. Транс-синаптична промяна в анионния градиент в невроните на гръбначния ламина I като механизъм на невропатична болка. природата. 2003;424:938–942. [PubMed]
Cox JJ, Reimann F, Nicholas AK, Thornton G, Roberts E, Springell K, Karbani G, Jafri H, Mannan J, Raashid Y и др. SCN9A каналопатия причинява вродена невъзможност за изпитване на болка. природата. 2006;444:894–898. [PubMed]
Крус-Оренго Л, Дака А, Хойерман Р.Д., Йънг Ти Джей, Монтана МС, Кавано ЕДжей, Ким Д., Story GM. Кожна ноцицепция, предизвикана от 15-делта PGJ2 чрез активиране на йонния канал TRPA1. Mol Pain. 2008;4:30. [Безплатна статия за PMC] [PubMed]
Дейвис А, Хендрич Дж, Ван Мин AT, Wratten J, Дъглас Л, Делфин AC. Функционална биология на алфа (2) делта субединиците на волтаж-зависимите калциеви канали. Тенденции Pharmacol Sci. 2007;28:220–228. [PubMed]
Дейвис JB, Grey J, Gunthorpe MJ, Hatcher JP, Davey PT, Overend P, Harries MH, Latcham J, Clapham C, Atkinson K и др. Ванилоидният рецептор-1 е от съществено значение за възпалителна термична хипералгезия. природата. 2000;405:183–187. [PubMed]
DeLeo JA, Соркин LS, Watkins LR, редактори. Имунно и глиално регулиране на болката. IASP; Сиатъл: 2007 г.
de Vries B, Frants RR, Ferrari MD, van den Maagdenberg AM. Молекулярна генетика на мигрена. Хъм Жене. 2009;126:115–132. [PubMed]
Dhaka A, Murray AN, Mathur J, Earley TJ, Petrus MJ, Patapoutian A. TRPM8 е необходим за усещане за студ при мишки. неврон. 2007;54:371–378. [PubMed]
Диб-Хадж SD, Янг Y, Waxman SG. Генетика и молекулярна патофизиология на болкови синдроми, свързани с Na(v)1.7. Adv Genet. 2008;63:85–110. [PubMed]
Dick IE, Brochu RM, Purohit Y, Kaczorowski GJ, Martin WJ, Priest BT. Блокадата на натриевите канали може да допринесе за аналгетичната ефикасност на антидепресантите. J Болка. 2007;8:315–324. [PubMed]
Dobler TM, Springauf A, Tovornik S, Weber M, Schmitt A, Sedlmeier R, Wischmeyer E, Doring F. TRESK каналите с две пори домена K+ представляват значителен компонент на фоновите калиеви токове в миши DRG неврони. J Physiol 2007 [статия без PMC] [PubMed]
Dong X, Han S, Zylka MJ, Simon MI, Anderson DJ. Разнообразно семейство от GPCR, експресирани в специфични подгрупи от ноцицептивни сензорни неврони. клетка. 2001;106:619–632. [PubMed]
Drdla R, Sandkuhler J. Дългосрочно потенциране в синапсите на C-влакна чрез пресинаптична активност на ниско ниво in vivo. Mol Pain. 2008;4:18. [Безплатна статия за PMC] [PubMed]
Drew LJ, Rohrer DK, Price MP, Blaver KE, Cockayne DA, Cesare P, Wood JN. Чувстващите киселини йонни канали ASIC2 и ASIC3 не допринасят за механично активирани токове в сензорните неврони на бозайници. J Physiol. 2004;556:691–710. [Безплатна статия за PMC] [PubMed]
Drew LJ, Wood JN, Cesare P. Различни механочувствителни свойства на чувствителни към капсаицин и нечувствителни сензорни неврони. J Neurosci. 2002;22:RC228. [PubMed]
Estacion M, Dib-Hajj SD, Benke PJ, Te Morsche RH, Eastman EM, Macala LJ, Drenth JP, Waxman SG. Мутации на усилване на функцията на NaV1.7 като континуум: A1632E показва физиологични промени, свързани с еритромелалгия и мутации на пароксизмални екстремни болкови разстройства и предизвиква симптоми на двете заболявания. J Neurosci. 2008;28:11079–11088. [PubMed]
Fertleman CR, Baker MD, Parker KA, Moffatt S, Elmslie FV, Abrahamsen B, Ostman J, Klugbauer N, Wood JN, Gardiner RM и др. SCN9A мутации при пароксизмално екстремно болково разстройство: алелни варианти са в основата на различни дефекти на канала и фенотипове. неврон. 2006;52:767–774. [PubMed]
Gevaert T, Vriens J, Segal A, Everaerts W, Roskams T, Talavera K, Owsianik G, Liedtke W, Daelemans D, Dewachter I и др. Делецията на преходния рецепторен потенциален катионен канал TRPV4 уврежда изпразването на миши пикочен мехур. J Clin Invest. 2007;117:3453–3462. [Безплатна статия за PMC] [PubMed]
Grant AD, Cottrell GS, Amadesi S, Trevisani M, Nicoletti P, Materazzi S, Altier C, Cenac N, Zamponi GW, Bautista-Cruz F и др. Активираният от протеаза рецептор 2 сенсибилизира преходния рецепторен потенциал ванилоиден 4 йонен канал, за да причини механична хипералгезия при мишки. J Physiol. 2007;578:715–733. [Безплатна статия за PMC] [PubMed]
Guler AD, Lee H, Iida T, Shimizu I, Tominaga M, Caterina M. Топлинно предизвикано активиране на йонния канал, TRPV4. J Neurosci. 2002;22:6408–6414. [PubMed]
Harvey RJ, Depner UB, Wassle H, Ahmadi S, Heindl C, Reinold H, Smart TG, Harvey K, Schutz B, Abo-Salem OM и др. GlyR alpha3: основна цел за гръбначна PGE2-медиирана сенсибилизация на възпалителна болка. наука. 2004;304:884–887. [PubMed]
Haynes SE, Hollopeter G, Yang G, Kurpius D, Dailey ME, Gan WB, Julius D. P2Y12 рецепторът регулира микроглиалната активация от извънклетъчни нуклеотиди. Nat Neurosci. 2006;9:1512–1519. [PubMed]
Hensel H, Zotterman Y. Ефектът на ментола върху терморецепторите. Acta Physiol Scand. 1951;24:27–34. [PubMed]
Hefti FF, Rosenthal A, Walicke PA, Wyatt S, Vergara G, Shelton DL, Davies AM. Нов клас лекарства за болка, базирани на антагонизъм на NGF. Тенденции Pharmacol Sci. 2006;27:85–91. [PubMed]
Hensel H, Zotterman Y. Ефектът на ментола върху терморецепторите. Acta Physiol Scand. 1951;24:27–34. [PubMed]
Hill K, Schaefer M. TRPA1 е диференциално модулиран от амфипатичните молекули тринитрофенол и хлорпромазин. J Biol Chem. 2007;282:7145–7153. [PubMed]
Hinman A, Chuang HH, Bautista DM, Julius D. Активиране на TRP канал чрез обратима ковалентна модификация. Proc Natl Acad Sci US A. 2006;103:19564–19568. [Безплатна статия за PMC] [PubMed]
Honore P, Chandran P, Hernandez G, Gauvin DM, Mikusa JP, Zhong C, Joshi SK, Ghilardi JR, Sevcik MA, Fryer RM и др. Многократното дозиране на ABT-102, мощен и селективен TRPV1 антагонист, повишава TRPV1-медиираната аналгетична активност при гризачи, но отслабва индуцираната от антагонисти хипертермия. Болка. 2009;142:27–35. [PubMed]
Honore P, Donnelly-Roberts D, Namovic MT, Hsieh G, Zhu CZ, Mikusa JP, Hernandez G, Zhong C, Gauvin DM, Chandran P и др. A-740003 [N-(1-{[(цианоимино)(5-хинолиниламино)метил]амино}-2,2-диметилпропил)-2-(3,4-диметоксифенил)ацетамид], нов и селективен P2X7 рецепторен антагонист , дозозависимо намалява невропатичната болка при плъхове. J Pharmacol Exp Ther. 2006;319:1376–1385. [PubMed]
Ху Дж, Люин GR. Механочувствителни токове в невритите на култивирани миши сензорни неврони. J Physiol. 2006;577:815–828. [Безплатна статия за PMC] [PubMed]
Immke DC, McCleskey EW. Лактатът засилва чувствителния към киселина Na+ канал върху чувствителните за исхемия неврони. Nat Neurosci. 2001;4:869–870. [PubMed]
Immke DC, McCleskey EW. Протоните отварят киселинно-чувствителни йонни канали, като катализират облекчаването на Ca2+ блокадата. неврон. 2003;37:75–84. [PubMed]
Ji RR, Samad TA, Jin SX, Schmoll R, Woolf CJ. Активирането на p38 MAPK от NGF в първичните сензорни неврони след възпаление повишава нивата на TRPV1 и поддържа топлинна хипералгезия. неврон. 2002;36:57–68. [PubMed]
Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, Meng ID, Julius D. Синапените масла и канабиноидите възбуждат сетивните нервни влакна чрез TRP канала ANKTM1. природата. 2004;427:260–265. Epub 2004 януари 2007 г. [PubMed]
Юлий Д, Басбаум AI. Молекулни механизми на ноцицепция. природата. 2001;413:203–210. [PubMed]
Karashima Y, Damann N, Prenen J, Talavera K, Segal A, Voets T, Nilius B. Бимодално действие на ментол върху преходния рецепторен потенциален канал TRPA1. J Neurosci. 2007;27:9874–9884. [PubMed]
Karashima Y, Talavera K, Everaerts W, Janssens A, Kwan KY, Vennekens R, Nilius B, Voets T. TRPA1 действа като сензор за студ in vitro и in vivo. Proc Natl Acad Sci US A. 2009;106:1273–1278. [Безплатна статия за PMC] [PubMed]
Kawasaki Y, Kohno T, Zhuang ZY, Brenner GJ, Wang H, Van Der Meer C, Befort K, Woolf CJ, Ji RR. Йонотропни и метаботропни рецептори, протеин киназа А, протеин киназа С и Src допринасят за активиране на ERK, предизвикано от С-фибри, и фосфорилиране на протеин, свързващ сАМР отговор, в невроните на дорзалния рог, което води до централна сенсибилизация. J Neurosci. 2004;24:8310–8321. [PubMed]
Keller AF, Beggs S, Salter MW, De Koninck Y. Трансформация на изхода на неврони на гръбначния ламина I след увреждане на нерва и стимулация на микроглия, лежаща в основата на невропатичната болка. Mol Pain. 2007;3:27. [Безплатна статия за PMC] [PubMed]
Kim D, Kim MA, Cho IH, Kim MS, Lee S, Jo EK, Choi SY, Park K, Kim JS, Akira S и др. Критична роля на toll-подобен рецептор 2 в индуцираното от нервно увреждане активиране на глиални клетки на гръбначния мозък и свръхчувствителност към болка. J Biol Chem. 2007;282:14975–14983. [PubMed]
Kindt KS, Viswanath V, Macpherson L, Quast K, Hu H, Patapoutian A, Schafer WR. Caenorhabditis elegans TRPA-1 функционира в механочувствителност. Nat Neurosci. 2007;10:568–577. [PubMed]
Kirschstein T, Busselberg D, Treede RD. Коекспресия на топлинно предизвикани и предизвикани от капсаицин вътрешни потоци в остро дисоциирани ганглийни неврони на гръбначния корен на плъх. Neurosci Lett. 1997;231:33–36. [PubMed]
Knabl J, Witschi R, Hosl K, Reinold H, Zeilhofer UB, Ahmadi S, Brockhaus J, Sergejeva M, Hess A, Brune K и др. Обръщане на патологичната болка чрез специфични подтипове на гръбначния GABAA рецептор. природата. 2008;451:330–334. [PubMed]
Kobayashi K, Yamanaka H, Fukuoka T, Dai Y, Obata K, Noguchi K. Повишаването на P2Y12 рецептора в активирана микроглия е портал за p38 сигнализиране и невропатична болка. J Neurosci. 2008;28:2892–2902. [PubMed]
Kwan KY, Allchorne AJ, Vollrath MA, Christensen AP, Zhang DS, Woolf CJ, Corey DP. TRPA1 допринася за студена, механична и химическа ноцицепция, но не е от съществено значение за трансдукцията на космените клетки. неврон. 2006;50:277–289. [PubMed]
Kwan KY, Glazer JM, Corey DP, Rice FL, Stucky CL. TRPA1 модулира механотрансдукцията в кожните сензорни неврони. J Neurosci. 2009;29:4808–4819. [Безплатна статия за PMC] [PubMed]
Латремолиер А, Улф CJ. Централна сенсибилизация: генератор на свръхчувствителност към болка чрез централна невронна пластичност. J Болка. 2009;10:895–926. [Безплатна статия за PMC] [PubMed]
Lawson JJ, McIlwrath SL, Woodbury CJ, Davis BM, Koerber HR. TRPV1 за разлика от TRPV2 е ограничен до подгрупа от механично нечувствителни кожни ноцицептори, реагиращи на топлина. J Болка. 2008;9:298–308. [Безплатна статия за PMC] [PubMed]
Leffler A, Linte RM, Nau C, Reeh P, Babes A. Високопрагови топлинно активирани канали в култивирани неврони на гръбначния корен на плъх наподобява TRPV2 и е блокиран от гадолиний. Eur J Neurosci. 2007;26:12–22. [PubMed]
Liedtke W, Choe Y, Marti-Renom MA, Bell AM, Denis CS, Sali A, Hudspeth AJ, Friedman JM, Heller S. Осмотично активиран канал, свързан с ванилоиден рецептор (VR-OAC), кандидат осморецептор за гръбначни животни. клетка. 2000;103:525–535. [Безплатна статия за PMC] [PubMed]
Liedtke W, Friedman JM. Анормална осмотична регулация при trpv4-/-мишки. Proc Natl Acad Sci US A. 2003;100:13698–13703. [Безплатна статия за PMC] [PubMed]
Lin YW, Cheng CM, Leduc PR, Chen CC. Разбиране на механотрансдукцията на сензорните нерви чрез локализиран контрол на еластомерната матрица. PLoS One. 2009;4:e4293. [Безплатна статия за PMC] [PubMed]
Lindia JA, McGowan E, Jochnowitz N, Abbadie C. Индукция на експресия на CX3CL1 в астроцити и CX3CR1 в микроглия в гръбначния мозък на модел на невропатична болка при плъх. J Болка. 2005;6:434–438. [PubMed]
Liu XJ, Gingrich JR, Vargas-Caballero M, Dong YN, Sengar A, Beggs S, Wang SH, Ding HK, Frankland PW, Salter MW. Лечение на възпалителна и невропатична болка чрез отделяне на Src от NMDA рецепторния комплекс. Nat Med. 2008;14:1325–1332. [Безплатна статия за PMC] [PubMed]
Lumpkin EA, Caterina MJ. Механизми на сензорна трансдукция в кожата. природата. 2007;445:858–865. [PubMed]
Luo ZD, Chaplan SR, Higuera ES, Sorkin LS, Stauderman KA, Williams ME, Yaksh TL. Регулиране на ганглий на гръбначния корен (алфа) 2 (делта) калциев канал и неговата корелация с алодиния при увредени гръбначни нерви плъхове. J Neurosci. 2001;21:1868–1875. [PubMed]
Macpherson LJ, Dubin AE, Evans MJ, Marr F, Schultz PG, Cravatt BF, Patapoutian A. Вредните съединения активират йонните канали на TRPA1 чрез ковалентна модификация на цистеините. природата. 2007;445:541–545. [PubMed]
Madrid R, de la Pena E, Donovan-Rodriguez T, Belmonte C, Viana F. Променливият праг на тригеминалните студено-термочувствителни неврони се определя от баланса между TRPM8 и Kv1 калиеви канали. J Neurosci. 2009;29:3120–3131. [PubMed]
Malan TP, Mata HP, Porreca F. Фармакология на гръбначния GABA(A) и GABA(B) рецептор в модел на невропатична болка при плъх. анестезиология. 2002;96:1161–1167. [PubMed]
Malmberg AB, Chen C, Tonegawa S, Basbaum AI. Запазена остра болка и намалена невропатична болка при мишки без PKCgamma. наука. 1997;278:279–283. [PubMed]
Mandadi S, Sokabe T, Shibasaki K, Katanosaka K, Mizuno A, Moqrich A, Patapoutian A, Fukumi-Tominaga T, Mizumura K, Tominaga M. TRPV3 в кератиноцитите предава информация за температурата на сензорните неврони 2009 г. [статия без PMC] [PubMed]
Materazzi S, Nassini R, Andre E, Campi B, Amadesi S, Trevisani M, Bunnett NW, Patacchini R, Geppetti P. Кокс-зависимите метаболити на мастни киселини причиняват болка чрез активиране на дразнещия рецептор TRPA1. Proc Natl Acad Sci US A. 2008;105:12045–12050. [Безплатна статия за PMC] [PubMed]
Matta JA, Cornett PM, Miyares RL, Abe K, Sahibzada N, Ahern GP. Общите анестетици активират ноцицептивен йонен канал за усилване на болката и възпалението. Proc Natl Acad Sci US A. 2008;105:8784–8789. [Безплатна статия за PMC] [PubMed]
McKemy DD, Neuhausser WM, Julius D. Идентифицирането на студен рецептор разкрива обща роля на TRP каналите в термосензацията. природата. 2002;416:52–58. [PubMed]
McMahon SB, Bennett DLH, Bevan S. Възпалителни медиатори и модулатори на болката. В: McMahon SB, Koltzenburg M, редактори. Учебникът по болката на Уол и Мелзак. Elsevier; 2008. С. 49–72.
Melzack R, Wall PD. Механизми на болката: нова теория. наука. 1965;150:971–979. [PubMed]
Messinger RB, Naik AK, Jagodic MM, Nelson MT, Lee WY, Choe WJ, Orestes P, Latham JR, Todorovic SM, Jevtovic-Todorovic V. In vivo заглушаване на Ca(V)3.2 T-тип калциеви канали в сензорните неврони облекчава хипералгезията при плъхове със стрептозоцин-индуцирана диабетна невропатия. Болка. 2009;145:184–195. [Безплатна статия за PMC] [PubMed]
Милиган ED, Sloane EM, Watkins LR. Глия при патологична болка: роля на фракталкина. J Невроимунол. 2008;198:113–120. [Безплатна статия за PMC] [PubMed]
Milligan ED, Zapata V, Chacur M, Schoeniger D, Biedenkapp J, O'Connor KA, Verge GM, Chapman G, Green P, Foster AC и др. Доказателство, че екзогенният и ендогенният фракталкин може да предизвика гръбначно ноцицептивно улесняване при плъхове. Eur J Neurosci. 2004;20:2294–2302. [PubMed]
Miraucourt LS, Dallel R, Voisin DL. Инхибиторната дисфункция на глицина превръща докосването в болка чрез PKCgamma интерневрони. PLoS One. 2007;2:e1116. [Безплатна статия за PMC] [PubMed]
Mochizuki T, Sokabe T, Araki I, Fujishita K, Shibasaki K, Uchida K, Naruse K, Koizumi S, Takeda M, Tominaga M. Катионният канал TRPV4 медиира предизвикан от разтягане приток на Ca2+ и освобождаване на АТФ в първични уротелни клетъчни култури. J Biol Chem. 2009;284:21257–21264. [Безплатна статия за PMC] [PubMed]
Мур KA, Kohno T, Karchewski LA, Scholz J, Baba H, Woolf CJ. Частичното увреждане на периферния нерв насърчава селективна загуба на GABAergic инхибиране в повърхностния гръбен рог на гръбначния мозък. J Neurosci. 2002;22:6724–6731. [PubMed]
Mueller KL, Hoon MA, Erlenbach I, Chandrashekar J, Zuker CS, Ryba NJ. Рецепторите и кодираща логика за горчив вкус. природата. 2005;434:225–229. [PubMed]
Muraki K, Iwata Y, Katanosaka Y, Ito T, Ohya S, Shigekawa M, Imaizumi Y. TRPV2 е компонент на осмотично чувствителни катионни канали в миши аортни миоцити. Circ Res. 2003;93:829–838. [PubMed]
Nagata K, Duggan A, Kumar G, Garcia-Anoveros J. Ноцицептор и свойства на преобразувател на космените клетки на TRPA1, канал за болка и слух. J Neurosci. 2005;25:4052–4061. [PubMed]
Nagy I, Rang H. Вредната топлина активира всички чувствителни към капсаицин, а също и подпопулация от нечувствителни към капсаицин ганглийни неврони на гръбначния корен. Неврология. 1999;88:995–997. [PubMed]
Nassar MA, Levato A, Stirling LC, Wood JN. Невропатичната болка се развива нормално при мишки без Na(v)1.7 и Na(v)1.8. Mol Pain. 2005; 1:24. [Безплатна статия за PMC] [PubMed]
Nassar MA, Stirling LC, Forlani G, Baker MD, Matthews EA, Dickenson AH, Wood JN. Ноцицептор-специфичната генна делеция разкрива основна роля на Nav1.7 (PN1) при остра и възпалителна болка. Proc Natl Acad Sci US A. 2004;101:12706–12711. [Безплатна статия за PMC] [PubMed]
Neumann S, Braz JM, Skinner K, Llewellyn-Smith IJ, Basbaum AI. Безвреден, не вреден, вход активира PKCgamma интерневроните на гръбначния гръбначен рог чрез миелинизирани аферентни влакна. J Neurosci. 2008;28:7936–7944. [Безплатна статия за PMC] [PubMed]
Nichols ML, Allen BJ, Rogers SD, Ghilardi JR, Honore P, Luger NM, Finke MP, Li J, Lappi DA, Simone DA и др. Предаване на хронична ноцицепция от гръбначни неврони, експресиращи рецептора на веществото Р. наука. 1999;286:1558–1561. [PubMed]
Noel J, Zimmermann K, Busserolles J, Deval E, Alloui A, Diochot S, Guy N, Borsotto M, Reeh P, Eschalier A и др. Механо-активираните K+ канали TRAAK и TREK-1 контролират както топло, така и студено възприятие. EMBO J. 2009;28:1308–1318. [Безплатна статия за PMC] [PubMed]
Obata K, Katsura H, Miyoshi K, Kondo T, Yamanaka H, Kobayashi K, Dai Y, Fukuoka T, Akira S, Noguchi K. Toll-подобен рецептор 3 допринася за гръбначната глиална активация и тактилна алодиния след нараняване на нерва. J Neurochem 2008 [PubMed]
Olausson H, Cole J, Rylander K, McGlone F, Lamarre Y, Wallin BG, Kramer H, Wessberg J, Elam M, Bushnell MC и др. Функционална роля на немиелинизирани тактилни аференти в човешката окосмена кожа: симпатикова реакция и перцептивна локализация. Exp Brain Res. 2008;184:135–140. [PubMed]
Page AJ, Brierley SM, Martin CM, Martinez-Salgado C, Wemmie JA, Brennan TJ, Symonds E, Omari T, Lewin GR, Welsh MJ и др. Йонният канал ASIC1 допринася за висцералната, но не и кожната механорецепторна функция. Гастроентерология. 2004;127:1739–1747. [PubMed]
Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, Earley TJ, Dragoni I, McIntyre P, Bevan S и др. TRP канал, който усеща студени стимули и ментол. клетка. 2002a;108:705–715. [PubMed]
Peier AM, Reeve AJ, Andersson DA, Moqrich A, Earley TJ, Hergarden AC, Story GM, Colley S, Hogenesch JB, McIntyre P и др. Топлочувствителен TRP канал, експресиран в кератиноцити. наука. 2002b;296:2046–2049. [PubMed]
Perl ER. Идеи за болката, исторически поглед. Nat Rev Neurosci. 2007;8:71–80. [PubMed]
Petrus M, Peier AM, Bandell M, Hwang SW, Huynh T, Olney N, Jegla T, Patapoutian A. Ролята на TRPA1 в механичната хипералгезия се разкрива чрез фармакологично инхибиране. Mol Pain. 2007; 3:40. [Безплатна статия за PMC] [PubMed]
Polgar E, Hughes DI, Arham AZ, Todd AJ. Загуба на неврони от ламини I-III на гръбначния гръбначен рог не е необходима за развитието на тактилна алодиния в модела на невропатична болка на пощаден нерв. J Neurosci. 2005;25:6658–6666. [PubMed]
Порека Ф, Осипов МХ, Гебхарт Г.Ф. Хронична болка и медуларно низходящо улесняване. Тенденции Neurosci. 2002;25:319–325. [PubMed]
Price MP, Lewin GR, McIlwrath SL, Cheng C, Xie J, Heppenstall PA, Stucky CL, Mannsfeldt AG, Brennan TJ, Drummond HA и др. Натриевият канал BNC1 на бозайниците е необходим за нормалното усещане за докосване. природата. 2000;407:1007–1011. [PubMed]
Price MP, McIlwrath SL, Xie J, Cheng C, Qiao J, Tarr DE, Sluka KA, Brennan TJ, Lewin GR, Welsh MJ. Катионният канал DRASIC допринася за откриването на кожни докосвания и киселинни стимули при мишки. неврон. 2001;32:1071–1083. [PubMed]
Rau KK, Jiang N, Johnson RD, Cooper BY. Топлинна сенсибилизация в кожни и мускулни ноцицептори, експресиращи различни комбинации от протеин TRPV1 и TRPV2. J Неврофизиол. 2007;97:2651–2662. [PubMed]
Rauck RL, Wallace MS, Burton AW, Kapural L, North JM. Интратекален зиконотид за невропатична болка: преглед. Практика за болка. 2009;9:327–337. [PubMed]
Рийд Г, Флонта МЛ. Физиология. Студен ток в терморецептивните неврони. природата. 2001;413:480. [PubMed]
Ren K, Dubner R. Неврон-глиа кръстосаните смущения стават сериозни: роля при свръхчувствителност към болка. Curr Opin Анестезиол. 2008;21:570–579. [Безплатна статия за PMC] [PubMed]
Ritner HL, Machelska H, Stein C. Болка и аналгезия на имунната система. В: Basbaum AI, Bushnell M, редактори. Наука за болката. 2009. с. 407–427.
Roza C, Puel JL, Kress M, Baron A, Diochot S, Lazdunski M, Waldmann R. Нокаутът на ASIC2 канала при мишки не нарушава кожната механосензация, висцералната механоноцицепция и слуха. J Physiol. 2004;558:659–669. [Безплатна статия за PMC] [PubMed]
Шерер Г, Имамачи Н, Цао YQ, Контет С, Меникен Ф, О'Донъл Д, Кийфър BL, Басбаум AI. Дисоциация на механизмите на опиоидните рецептори, които контролират механичната и топлинна болка. клетка. 2009;137:1148–1159. [Безплатна статия за PMC] [PubMed]
Schmidt R, Schmelz M, Forster C, Ringkamp M, Torebjork E, Handwerker H. Нови класове от отзивчиви и неотзивчиви C ноцицептори в човешката кожа. J Neurosci. 1995;15:333–341. [PubMed]
Sivilotti L, Woolf CJ. Приносът на GABAA и глициновите рецептори към централната сенсибилизация: дезинхибиране и алодиния, предизвикана от докосване в гръбначния мозък. J Неврофизиол. 1994;72:169–179. [PubMed]
Snider WD, McMahon SB. Справяне с болката при източника: нови идеи за ноцицепторите. неврон. 1998;20:629–632. [PubMed]
Story GM, Peier AM, Reeve AJ, Eid SR, Mosbacher J, Hricik TR, Earley TJ, Hergarden AC, Andersson DA, Hwang SW и др. ANKTM1, TRP-подобен канал, експресиран в ноцицептивни неврони, се активира от ниски температури. клетка. 2003;112:819–829. [PubMed]
Strotmann R, Harteneck C, Nunnenmacher K, Schultz G, Plant TD. OTRPC4, неселективен катионен канал, който придава чувствителност към извънклетъчен осмоларитет. Nat Cell Biol. 2000;2:695–702. [PubMed]
Sugai E, Morimitsu Y, Iwasaki Y, Morita A, Watanabe T, Kubota K. Остри качества на съединения, свързани със sanshool, оценени чрез сензорен тест и активиране на TRPV1 на плъхове. Biosci Biotechnol Biochem. 2005;69:1951–1957. [PubMed]
Suzuki M, Watanabe Y, Oyama Y, Mizuno A, Kusano E, Hirao A, Ookawara S. Локализация на механочувствителния канал TRPV4 в кожата на мишката. Neurosci Lett. 2003;353:189–192. [PubMed]
Swayne LA, Bourinet E. Волтаж-зависими калциеви канали при хронична болка: възникваща роля на алтернативно снаждане. Pflugers Arch. 2008;456:459–466. [PubMed]
Takahashi A, Gotoh H. Механочувствителни токове на цялата клетка в култивирани соматосензорни неврони на плъх. Brain Res. 2000;869:225–230. [PubMed]
Tanga FY, Nutile-McMenemy N, DeLeo JA. Ролята на ЦНС на Toll-подобен рецептор 4 при вродения невроимунитет и болезнена невропатия. Proc Natl Acad Sci US A. 2005;102:5856–5861. [Безплатна статия за PMC] [PubMed]
Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, Raumann BE, Basbaum AI, Julius D. Клонираният капсаицин рецептор интегрира множество стимули, предизвикващи болка. неврон. 1998;21:531–543. [PubMed]
Торсни C, MacDermott AB. Дезинхибирането отваря портата за патологична сигнализация за болка в повърхностни неврокинин-1 рецептор-експресиращи неврони в гръбначния мозък на плъх. J Neurosci. 2006;26:1833–1843. [PubMed]
Tozaki-Saitoh H, Tsuda M, Miyata H, Ueda K, Kohsaka S, Inoue K. P2Y12 рецепторите в гръбначната микроглия са необходими за невропатична болка след увреждане на периферния нерв. J Neurosci. 2008;28:4949–4956. [PubMed]
Trevisani M, Siemens J, Materazzi S, Bautista DM, Nassini R, Campi B, Imamachi N, Andre E, Patacchini R, Cottrell GS и др. 4-Хидроксиноненал, ендогенен алдехид, причинява болка и неврогенно възпаление чрез активиране на дразнещия рецептор TRPA1. Proc Natl Acad Sci US A. 2007;104:13519–13524. [Безплатна статия за PMC] [PubMed]
Tsuda M, Shigemoto-Mogami Y, Koizumi S, Mizokoshi A, Kohsaka S, Salter MW, Inoue K. P2X4 рецептори, индуцирани в тактилна алодиния на гръбначния стълб на микроглия след увреждане на нерва. природата. 2003;424:778–783. [PubMed]
Ulmann L, Hatcher JP, Hughes JP, Chaumont S, Green PJ, Conquet F, Buell GN, Reeve AJ, Chessell IP, Rassendren F. Повишената регулация на P2X4 рецепторите в гръбначната микроглия след увреждане на периферния нерв медиира освобождаването на BDNF и невропатична болка. J Neurosci. 2008;28:11263–11268. [PubMed]
Verge GM, Milligan ED, Maier SF, Watkins LR, Naeve GS, Foster AC. Разпределение на фракталкин (CX3CL1) и фракталкин рецептор (CX3CR1) в гръбначния мозък и ганглиите на гръбначния корен при базална и невропатична болка. Eur J Neurosci. 2004;20:1150–1160. [PubMed]
Viana F, de la Pena E, Belmonte C. Специфичността на студената термотрансдукция се определя чрез диференциална експресия на йонни канали. Nat Neurosci. 2002;5:254–260. [PubMed]
Wetzel C, Hu J, Riethmacher D, Benckendorff A, Harder L, Eilers A, Moshourab R, Kozlenkov A, Labuz D, Caspani O и др. Протеин от стоматинов домейн, който е от съществено значение за усещането за докосване на мишката. природата. 2007;445:206–209. [PubMed]
Woodbury CJ, Zwick M, Wang S, Lawson JJ, Caterina MJ, Koltzenburg M, Albers KM, Koerber HR, Davis BM. Ноцицепторите без TRPV1 и TRPV2 имат нормални топлинни реакции. J Neurosci. 2004;24:6410–6415. [PubMed]
Улф Си Джей. Доказателство за централен компонент на свръхчувствителност към болка след нараняване. природата. 1983;306:686–688. [PubMed]
Yagi J, Wenk HN, Naves LA, McCleskey EW. Продължителни токове през ASIC3 йонни канали при умерени промени в pH, които възникват по време на миокардна исхемия. Circ Res. 2006;99:501–509. [PubMed]
Якш ТЛ. Поведенчески и автономни корелати на тактилно предизвикана алодиния, произведена от инхибиране на гръбначния глицин: ефекти на модулаторни рецепторни системи и възбуждащи аминокиселинни антагонисти. Болка. 1989;37:111–123. [PubMed]
Yang Y, Wang Y, Li S, Xu Z, Li H, Ma L, Fan J, Bu D, Liu B, Fan Z и др. Мутации в SCN9A, кодиращи алфа субединица на натриев канал, при пациенти с първична еритермалгия. J Med Genet. 2004;41:171–174. [Безплатна статия за PMC] [PubMed]
Zamponi GW, Lewis RJ, Todorovic SM, Arneric SP, Snutch TP. Роля на волтаж-зависимите калциеви канали във възходящите пътища на болката. Brain Res Rev. 2009; 60:84–89. [Безплатна статия за PMC] [PubMed]
Zhuang ZY, Kawasaki Y, Tan PH, Wen YR, Huang J, Ji RR. Роля на пътя на CX3CR1/p38 MAPK в гръбначната микроглия за развитието на невропатична болка след разцепване на фракталкин, предизвикано от увреждане на нервите. Мозъчно поведение Immun. 2007;21:642–651. [Безплатна статия за PMC] [PubMed]
Zimmermann K, Leffler A, Babes A, Cendan CM, Carr RW, Kobayashi J, Nau C, Wood JN, Reeh PW. Сензорният неврон натриев канал Nav1.8 е от съществено значение за болка при ниски температури. природата. 2007;447:855–858. [PubMed]
Zurborg S, Yurgionas B, Jira JA, Caspani O, Heppenstall PA. Директно активиране на йонния канал TRPA1 от Ca2+ Nat Neurosci. 2007;10:277–279. [PubMed]
Допълнителни теми: Болка в гърба
Заболявания на опорно-двигателния апарат е една от най-разпространените причини за инвалидност и пропуснати дни по време на работа в световен мащаб. Всъщност, болката в гърба е приписана като втората най-често срещана причина за посещенията в лекарски кабинети, превишаващи броя им само чрез инфекции на горните дихателни пътища. Приблизително 80 процента от населението ще преживее някакъв вид болка в гърба поне веднъж през целия си живот. Гърбът е сложна структура, съставена от кости, стави, връзки и мускули, сред другите меки тъкани. Поради това, наранявания и / или влошени условия, като например херния дискове, може евентуално да доведе до симптоми на болки в гърба. Спортни наранявания или наранявания при автомобилни аварии често са най-честата причина за болки в гърба, но понякога най-простите от движенията могат да имат болезнени резултати. За щастие алтернативните възможности за лечение, като хиропрактика, могат да помогнат за облекчаване на болката в гърба чрез използване на корекции на гръбначния стълб и ръчни манипулации, като в крайна сметка подобряват облекчаването на болката.

ВАЖНА ТЕМА: Намаляване на болката в гърба
ОЩЕ ТЕМИ: EXTRA EXTRA: Хронична болка и лечение
Отказ от отговорност
Професионален обхват на практика *
Информацията тук на "Механизми на остра болка срещу хронична болка" няма за цел да замени личната връзка с квалифициран здравен специалист или лицензиран лекар и не е медицински съвет. Насърчаваме ви да вземате здравни решения въз основа на вашите изследвания и партньорство с квалифициран здравен специалист.
Информация за блога и дискусии за обхват
Нашият информационен обхват е ограничено до хиропрактика, мускулно-скелетна, акупунктура, физикални лекарства, уелнес, допринасящи етиологични висцерозоматични нарушения в рамките на клинични презентации, свързана соматовисцерална рефлексна клинична динамика, сублуксационни комплекси, чувствителни здравни проблеми и/или статии, теми и дискусии от функционална медицина.
Ние предоставяме и представяме клинично сътрудничество със специалисти от различни дисциплини. Всеки специалист се ръководи от своя професионален обхват на практика и своята юрисдикция за лицензиране. Използваме протоколи за функционално здраве и уелнес за лечение и поддържане на грижи за наранявания или нарушения на мускулно-скелетната система.
Нашите видеоклипове, публикации, теми, теми и прозрения обхващат клинични въпроси, проблеми и теми, които се отнасят до и пряко или косвено подкрепят нашия клиничен обхват на практика.*
Нашият офис разумно се е опитал да предостави подкрепящи цитати и е идентифицирал съответните изследвания, подкрепящи нашите публикации. Ние предоставяме копия на подкрепящи научни изследвания, достъпни за регулаторните съвети и обществеността при поискване.
Разбираме, че обхващаме въпроси, които изискват допълнително обяснение как може да подпомогне определен план за грижи или протокол за лечение; следователно, за да обсъдите допълнително темата по-горе, моля не се колебайте да попитате Д-р Алекс Хименес, окръг Колумбия, Или се свържете с нас на адрес 915-850-0900.
Ние сме тук, за да помогнем на вас и вашето семейство.
Благословения
Д-р Алекс Хименес н.е., MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
имейл: coach@elpasofunctionalmedicine.com
Лицензиран като доктор по хиропрактика (DC) в Тексас & Ню Мексико*
Тексас DC Лиценз # TX5807, Ню Мексико DC Лиценз # NM-DC2182
Лицензирана като регистрирана медицинска сестра (RN*) в Флорида
Флорида Лиценз RN Лиценз # RN9617241 (Контролен номер 3558029)
Компактен статус: Многодържавен лиценз: Упълномощен да практикува в 40 състояния*
Понастоящем записан: ICHS: MSN* FNP (Програма за практикуваща семейна медицинска сестра)
Д-р Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моята цифрова визитка




 Отново Ви приветстваме¸
Отново Ви приветстваме¸
